Второй закон термодинамики
Согласно второму закону термодинамики теплота самопроизвольно может переходить только от более нагретого тела к менее нагретому. Установлено, что в работу может превращаться только часть той теплоты, которая переходит от нагревателя к холодильнику, и тем большая, чем больше разность температур:
A = q 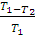 (2. 24)
(2. 24)
где q - теплота, отдаваемая нагревателем; T1—температура нагревателя; Т2 — температура холодильника.
Отношение  называется коэффициентом полезного действия (КПД) - η. Отсюда
называется коэффициентом полезного действия (КПД) - η. Отсюда
η = 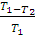 (2.25)
(2.25)
На основе второго закона термодинамики Клаузиус ввел понятие энтропии S — термодинамической функции системы. Изменение энтропии ∆S в каком-либо процессе зависит только от начального и конечного состояний системы и не зависит от пути перехода.
Наиболее просто ∆S определяется для обратимых неизолированных изотермических процессов:
∆S =  (2.26)
(2.26)
где q — количество теплоты, сообщенное системе.
При изотермическом плавлении или испарении количества вещества 1 моль: ∆S = ∆H/T
где ∆H - теплота плавления или теплота испарения.
Если происходит изотермическое расширение п моль идеального газа, то
∆S =nR • 2,3lgV2/V1 (2.28)
∆S = nR2,31gp1/p2 (2.29)
Если же в системе, состоящей из идеального газа, изменяется одновременно несколько параметров, то
∆S = пСv . 2,3lgT2/T1+ пR • 2,3 lgV2/V1 (2.30)
∆S = пСp • 2,3lgT2/T1 + пR ∙2,3lg p1/p2 (2.31)
∆S = п • 2,3(Cvlg p2/p1 + Cplg(V2/V1) (2.32)
Вычисление ∆S в необратимых процессах ведут по уравнениям для процессов обратимых. Это вполне закономерно, так как изменение энтропии при заданном начальном и конечном состояниях системы не зависит от пути перехода и, в частности, от обратимости процесса. Если необратимый и обратимый процессы проводятся в одних и тех же граничных условиях, то
∆Soбр =∆S неoбр.[2].
Примеры
1. К котлу с водой, находящейся при 100 °С, подвели 8374 Дж теплоты. Найти КПД и максимальную работу, которую можно получить от котла, если температура холодильника 30 °С.
Решение. Максимальную работу находим по уравнению (2.24):
А = q(T1 – T2/T1);
A = 8374 • (373 – 303)/373 = 1571 (Дж)
Согласно уравнению (2.25)
η = 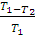 ;
;
η = 373-303/373= 0,1875, или 18,75 %
2. При временном контакте тела с температурой 200 °С с телом, нагретым до 100 °С, перешло 418,7 Дж теплоты. Найти общее изменение энтропии системы.
Решение. Изменение энтропии теплоотдатчика и теплоприемника находим по уравнению (2.26):
∆S1 =q/T;
∆S1 = -418,7/473 = - 0,885 (Дж)
∆S2 = 418,7/373 = 1,122 (Дж)
Находим общее изменение энтропии:
∆S = ∆S1 +∆S2; ∆S = -0,885+1,122 = 0,237 (Дж)
3. Азот объемом 0,001 м3 смешан с кислородом объемом 0,002 м3 при 27 °С и давлении 1,013 • 105 Па. Найти общее изменение энтропии системы.
Решение. При смешении газы будут диффундировать друг в друга. Межмолекулярным взаимодействием газов можно пренебречь, так как при данных условиях газы можно принять за идеальные. Поэтому общее изменение энтропии при смешении газов будет равно сумме изменений энтропий каждого газа при его расширении до объема смеси. Так как процесс изотермический, то из уравнения (1.28) для каждого газа
Из уравнения (1.8) n =pv/RT;
n(N2) = 0,001•1,013•105 = 0,0405;
n(O2) = 0,002•1,013•105/8,314•300 = 0,081;
∆S(N2) = 0,0405 • 8,314 • 2,3lg(0,003/0,001) = 0,371 (Дж)
∆S(O2) = 0,081• 8,314 • 2,3lg(0,003/0,002) = 0,274 (Дж)
∆S = 0,371 + 0,274 = 0,645 (Дж)
Эта задача может быть решена и по уравнению (2.29), нужно только по уравнению (2.11б) найти парциальные давления газов:
p(N2) = pоб 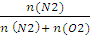 ;
;
p(N2) = 1,013 • 105 +0,0405/0,0405 + 0,081 = 0,337 * 105 (Па);
p(O2) = 1.013•105 – 0,337•105=0,676•105 (Па);
∆S(N2) = 0,0405•8,314•2,3lg(1,013•105/0,337•105)=0,371 (Дж);
∆S(O2) = 0,081•8,314•2,3lg(1,013•105/0,676•105)=0,274 (Дж);
∆S = 0,371+0,274=0,645 (Дж);
4. Вода массой 1 кг, взятая при 0 °С, переведена в состояние перегретого пара с температурой 200 °С и давлением 101,3 кПа. Вычислить изменение энтропии этого перехода, если удельная теплота испарения воды при 100 °С равна 2257 Дж/г, удельная теплоемкость воды равна 4,187 Дж (г•К), а удельная теплоемкость водяного пара при давлении в 1,013 • 105 Па равна 1,968 Дж (г•К).
Решение. Общее изменение энтропии будет складываться из трех составляющих: изменения энтропии ∆S1 при нагревании воды до температуры кипения, изменения энтропии ∆S2 при переходе воды из жидкого состояния в парообразное и, наконец, изменения энтропии ∆S3 при нагревании сухого пара от 100 до 200 °С: ∆S = ∆S1+∆S2 + ∆S3
∆S1 определяем по уравнению ∆S = пСр • 2,3lg(T2/T1) —. Оно получено из уравнения (II, 31), если предположить, что система подчиняется законам для идеальных газов и что объем воды при нагревании не изменяется. Молярная теплоемкость Ср равна удельной теплоемкости, умноженной на молярную массу: Ср = 4,187 • 18 = 75,4 (Дж/(моль • К);
п (Н20) = 1000 : 18 = 55,6 моль;
∆S1 = 55,6 • 75,4 • 2,3lg(373/273) = 1305,5 (Дж)
∆S2 находим по уравнению (II, 27). Молярная теплота испарения равна:
∆Hисп = 2256,7 • 18 = 40 620 (Дж/моль);
∆S2 = ∆Hисп/T; ∆S2 = 55,6 • 40 620/373 = 6065 (Дж)
При нагревании сухого пара от 100 до 200 °С при постоянном давлении изменение энтропии равно: ∆S3 = пСр • 2,3lg(T2/T1). Молярная теплоемкость пара Ср = 1,968 • 18 = 35,42 (Дж/моль).
∆S3 = 55,6 • 35,42 • 2,3lg(473/373) = 464,3 (Дж);
∆S = 1303,5 + 6055 + 464,3 = 7824,8 (Дж)
Дата добавления: 2016-12-09; просмотров: 3265;











