Воздух, необходимый для горения веществ и материалов
Индивидуальные химические вещества
Расчет производится по следующей формуле:
Vво = 4,76×b [м3/м3] или [кмоль/кмоль],
где (4,76 = 1 + 3,76) - это количество воздуха, в котором содержится 1 кмоль О2;
b - отношение количества молекул окислителя к количеству молекул горючего в уравнении реакции горения:
b = no2 / nг
Например, для метана bсн4 = 2/1 = 2.
Уравнение (17.4) в основном используется для газообразных горючих веществ.
Для твердых и жидких горючих веществ применяется уравнение:
Vво = 4,76b×Vо/Мг [м3/кг]
Для заданных условий имеем:
Vвт,р = 4,76b×Vот,р/Мг [м3/кг]
В этом случае предварительно рассчитывается по уравнению состояния идеальных газов объем 1 кмоля газов для заданных условий.
Мг - молярная масса горючего вещества.
Вещество сложного состава
Общий объем воздуха, необходимый для горения единицы массы вещества, будет складываться из объемов воздуха, необходимых для горения каждого из элементов, входящих в состав вещества, за вычетом объема воздуха, соответствующего количеству кислорода, содержащегося в веществе:
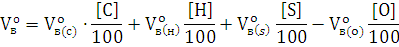
где Vво(с), Vво(н), Vво(s) - количество воздуха, необходимое для горения единицы массы соответствующего элемента (м3/кг);
Vво(о) - количество воздуха, в котором содержится 1 кг кислорода (м3/кг);
C, H, S, O - содержание соответствующего элемента в горючем веществе (% вес.).
Определим значения Vво(с), Vво(н), Vво(s)
С + О2 = СО2
nc = 1; no2 = 1; b(с) = 1;
Vво(с) = (4,76×1×Vo)/12;
Н2 + 0,5О2 = Н2О
nн = 1; no2 = 0,5; b(н) = 0,5;
Vво(н) = (4,76×0,5×Vo)/2;
S + О2 = SО2
ns = 1; no2 = 1; b(s) = 1;
Vво(с) = (4,76×1×Vo)/32.
Находим значение Vво(о) 1 кмоль О2 (32 кг) занимает объем при нормальных условиях Vo. Так как в воздухе на каждый объем кислорода приходится 3,76 объема азота, то 32 кг кислорода будет содержаться в 4,76×Vo м3 воздуха. Тогда Vво(о) = (4,76Vo)/32.
Подставляя полученные значения в уравнение и принимая, что Vo = 22,4 м3/кмоль, получаем:
Vво = 0,267 (С/3 + Н + (S-О)/8) [м3/кг]
Смесь газов
Для расчетов Vво необходимо провести расчеты для каждого газа, входящего в смесь, и полученные результаты сложить. Когда газовая смесь и воздух находятся в одних и тех же условиях, то объем воздуха, необходимый для полного сгорания смеси газов, можно определить по формуле:
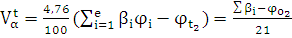 , [м3/м3]
, [м3/м3]
где jо2 - содержание кислорода в газовой смеси (% об.);
ji - содержание i-го компонента в газовой смеси (% об.).
Избыток воздуха
Разность между количеством воздуха, присутствующим при горении, и теоретически необходимым количеством воздуха называется избытком воздуха:
DVво = Vво(пр) - Vво
Отношение количества воздуха, практически участвующего в процессе горения, к теоретически необходимому называется коэффициентом избытка воздуха:
aв = Vво(пр)/Vво
Если известно количество кислорода, которое содержится в продуктах горения после сгорания горючего вещества, aв можно определить следующим образом:
aв = 21/(21-jо2 пг)
где jо2 пг - количество О2, содержащееся в продуктах горения (% об.).
В случае кинетического горения при Vво(пр) = Vво aв = 1. Смесь горючего с воздухом является стехиометрической.
При aв < 1 смесь богатая. Характерной чертой процесса горения является образование продуктов неполного горения.
При aв > 1 смесь бедная. Часть воздуха не расходуется на горение (избыток воздуха) и переходит в продукты горения.
DVво = Vво(пр) - Vво = Vво(aв - 1);
Vво(a) = Vво + DVво
Дата добавления: 2016-12-09; просмотров: 2383;











