Виды и режимы горения
Горение можно классифицировать по следующим параметрам:
1. По условию смесеобразования горючих компонентов:
а) кинетическое – горение предварительно перемешанных газо- или паровоздушных смесей. Так как смесь горючего и окислителя готова к горению до момента ее воспламенения, то суммарная скорость процесса горения зависит только от скорости химической реакции горения. Если такое горение будет происходить в замкнутом или ограниченном объеме, то тогда может произойти взрыв. Так как энергия, выделяющаяся при сгорании смеси, не успевает отводиться за пределы данного объема, за счет увеличения давления возможно разрушение конструкций;
б) диффузионное, диффузионным горением называется горение, когда образование горючей среды (смешение горючего и окислителя) происходит перед зоной горения или в зоне горения.
2. По интенсивности поступления горючих компонентов в зону химической реакции:
а) ламинарное, при этом компоненты горючей смеси поступают в зону горения сравнительно спокойно. При этом численное значение критерия Рейнольдса, который характеризует термодинамический режим, будет значительно меньше критического (Re<2300).
б) турбулентное, при этом компоненты горючей смеси поступают в зону горения с большой скоростью. Число Рейнольдса в этом случае больше 2300.
3. По агрегатному состоянию компонентов горючей смеси:
а) гомогенное горючее и окислитель находятся в одинаковом агрегатном состоянии (газообразном);
б) гетерогенное (разнофазное) - горючее и окислитель находятся в различных агрегатных состояниях.
4. По скорости распространения зоны химической реакции горения:
а) дефлаграционное (медленное) распространение зоны химической реакции (скорость от 0,5 до 50 м/с);
б) детонационное (взрывное), когда зона химической реакции горения распространяется со скоростью ударной волны (от нескольких сотен метров в секунду до нескольких километров в секунду).
Пространство, в котором сгорают пары или газы, называется пламенем.
Ламинарные пламена предварительно перемешанной смеси. В ламинарных пламенах предварительно перемешанной смеси горючее и окислитель смешиваются до начала горения и поток ламинарен.
Пламя предварительно перемешанной смеси называют стехиометрическим, если горючее (углеводород) и окислитель (кислород — О2) расходуют друг друга полностью, образуя двуокись углерода (СО2) и воду (Н2О). Если существует избыток горючего, говорят, что смесь богатая, а в случае избытка окислителя говорят, что смесь бедная [3].
Рассмотрим простейшие примеры:
1) 2Н2 + O2 → 2Н2О — стехиометрическая смесь,
2) ЗН2 + О2 → 2H2O + Н2 — богатая смесь (Н2 в избытке),
3) СН4 + ЗО2 → 2Н2О + СО2 + О2 - бедная смесь (О2 в избытке).
Каждый символ в таком уравнении химической реакции соответствует одному молю вещества. Так, первое из этих уравнений означает, что два моля Н2 реагируют с одним молем О2 с образованием двух молей Н2О.
Если уравнение химической реакции записано таким образом, что оно описывает реакцию именно одного моля горючего, то мольная доля горючего в стехиометрической смеси может быть легко определена из соотношения
хгор,стех = 1/ ((1+v)
Здесь v обозначает число молей О2 в уравнении реакции с образованием СО2 и Н2О. Примером служит реакция
H2+0,5O2→H2O, v=0,5, xH2,стех = 2/3
Если окислителем является воздух, то следует принимать во внимание, что сухой воздух содержит только 21 % кислорода, а также 78 % азота и 1 % благородных газов. Таким образом, для воздуха XN2 = 3,762 XO2. Отсюда мольные доли для стехиометрической смеси с воздухом будут равны
хгор,стех = 1/ ((1+v∙4,762), 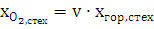 ,
,
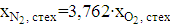
где v как и прежде означает количество молей О2 в уравнении реакции полного превращения одного моля горючего в СО2 и Н2О. Ряд примеров значений v и мольных долей горючего для стехиометрических смесей горючего с воздухом приведен в таблице 1.
Предварительно перемешанные смеси горючего и воздуха (в этом случае в уравнение реакции должно быть добавлено соответствующее количество N2, см. табл. 1) характеризуются величиной эквивалентного отношения для воздуха:
λ = (хвоз/хгор) / (хвоз,стех / хгор,стех) = (wвоз/wгор) / (wвоз,стех / wгор,стех)
либо обратной величиной — эквивалентным отношением для горючего Ф (Ф = 1/λ). Эту формулу можно преобразовать для того, чтобы можно было определить величины мольных долей смеси по значению Ф:
хгор = 1/ ((1+(4,762∙v) / Ф), хвоз = 1 – хгор ,
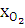 = хвоз / 4,762,
= хвоз / 4,762, 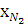 =
= 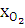 ∙3,762
∙3,762
Примеры значений v и мольных долей горючего xгор, стех для стехиометрических смесей горючего с воздухом
| Реакция | v | x |
| H2 + 0,5O2 + 0,5∙3,762N2→H2O + 0,5∙3,762N2 | 0,5 | 29,6 моль-% |
| CH4+2,0O2+2,0∙3,762N2 → CO2 +2H2O+2,0∙3,762N2 | 2,0 | 9,50 моль-% |
| C3H8 + 5,0O2+5,0∙3,762N2→ 3CO2 +4H2O+5,0∙3,762N2 | 5,0 | 4,03 моль-% |
| C7H16 + 11,0O2+11,0∙3,762N2→ 7CO2 +8H2O+11,0∙3,762N2 | 11,0 | 1,87 моль-% |
| C8H18 + 12,5O2+12,5∙3,762N2→ 8CO2 +9H2O+12,5∙3,762N2 | 12,5 | 1,65 моль-% |
Дата добавления: 2016-12-09; просмотров: 3659;











