Реакции деструкции полимеров
Это реакции разрыва главной цепи полимера. Причины могут быть физические (термическая, механическая, фотохимическая и радиационная), а также химические (окислительные реакции, гидролиз и другие).
Термическая деструкция
Ее интенсивность зависит от величины энергии связи между атомами. Связь С-С очень устойчива, однако наличие атомов водорода сильно понижает ее устойчивость:
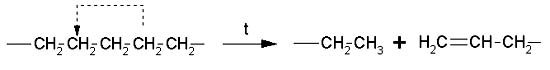
На прочность связи С-С влияет степень разветвленности полимеров и наличие заместителей в молекуле. Наиболее ослаблено место связи боковой и главной цепи. Полиэтилен более термостоек, чем полипропилен и полиизобутилен:
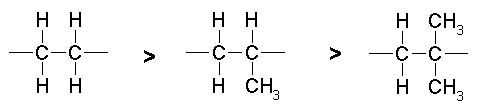
Некоторые заместители повышают термостойкость. Например, фтор:
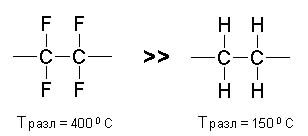
Кислород в любом месте цепи сильно снижает термостойкость.
Механическая деструкция. К механическим воздействиям относятся измельчение, вальцевание, смешение, продавливание через отверстия и др. Деструкция обусловлена локализацией механической энергии, возникновением внутренних напряжений, соизмеримых с энергией химической связи.
Радиационная деструкция. Степень деструкции зависит от энергии частиц и интенсивности облучения (суммарно от полученной дозы). Деструкция идет с образованием радикалов, ненасыщенных связей, с выделением газов. Иногда облучение способствует увеличению молекулярной массы (сшивки). Это заметно на ПАК, ПВС, ПВП, полиакриламиде.
Окислительная деструкция. Устойчивость полимера зависит от наличия окисляемых групп и связей в макромолекуле. Среди окислителей известны О2, Сl2, О3. Если Сl и F имеются в молекуле как заместители, устойчивость полимера возрастает. Она падает при нагревании, на свету.
Гидролиз
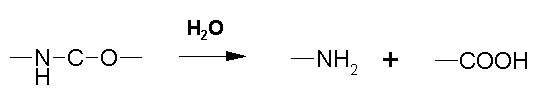
Это реакция присоединения молекул воды по месту разрыва химических связей. Наиболее подвержены гидролизу соединения, имеющие ацетальные, амидные и эфирные связи:
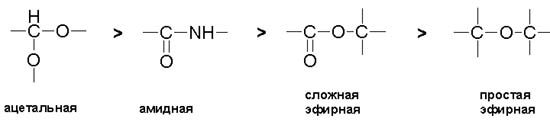
Большое значение имеет гидролизирующий агент. Целлюлоза очень слабо гидролизуется щелочью и сильно разбавленными кислотами по ацетальной связи. Наиболее сильными гидролизирующими агентами являются серная, соляная и фтористоводородная кислоты, которые омыляют целлюлозу до глюкозы.
Полиамиды гидролизуются в концентрированных серной, соляной и муравьиной кислотах:
Ацидолиз
Это деструкция под действием карбоновых кислот с образованием более низкомолекулярных продуктов (см. рис.6). Степень деструкции пропорциональна количеству дикарбоновой кислоты.
Аминолиз
Деструкция, протекающая под действием аминов. Пример: взаимодействие полиамидов с гексаметилендиамином:
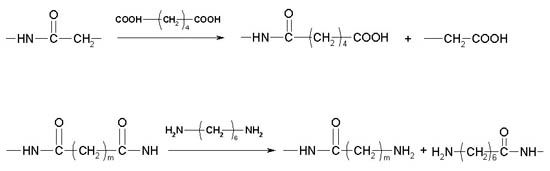
Рис. 6. Примеры реакций ацидолиза и аминолиза
Реакции сшивания.Это реакции образования поперечных химических связей между макромолекулами с образованием пространственной сетки. В резиновой промышленности эти реакции называются вулканизацией, в промышленности - отверждением.
При небольшом количестве поперечных связей (редкая сетка) получаются мягкие эластичные продукты, т.е. если степень сшивки полимера невысока, он сохраняет свою растворимость. Большое количество сшивок приводит к формированию очень жесткой структуры.
Поперечные связи могут образовываться между атомами углерода без добавления каких-либо веществ или при помощи вулканизаторов или отвердителей. Сера в каучуках - резина и эбонит (от 3 до 32% масс.). Так как при высокой плотности поперечно-сшивающих связей образуется нерастворимая трехмерная сетчатая структура, то такие сильносшитые материалы получают в результате термообработки и они называются термореактивными или термоотвержденными. Продукты - неплавкие и нерастворимые. Полимеры, у которых при нагревании не образуется поперечных связей, которые сохраняют свою растворимость и способность к плавлению, называются термопластичными.
Тема 2.2Размеры и формы реальных цепных молекул и их экспериментальное определение. Понятие о статистическом сегменте.
Полимеры, как и многие другие вещества, способны растворяться в растворителях, имеющих к ним термодинамическое сродство. Однако растворимость, процесс растворения и свойства растворов полимеров существенно отличаются от таковых для растворов низкомолекулярных веществ.При растворении твердого (аморфного или кристаллического) низкомолекулярного вещества происходит сольватация молекул или ионов, находящихся на поверхности растворяемого тела, и сольватированные молекулы или ионы транспортируются в растворитель. Движущей силой процесса является разница химических потенциалов в фазе растворяемого вещества и растворителя (раствора). Процесс идет до выравнивания химических потенциалов, тогда образуется насыщенный раствор. Если изменение свободной энергии Гиббса остается ниже нуля на протяжении всего процесса, то вещества растворяются друг в друге неограниченно во всем диапазоне концентраций. Поскольку размеры сольватированных молекул соизмеримы с размерами молекул растворителя, механические свойства раствора не отличаются существенным образом от свойств растворителя.
При растворения веществ высокомолекулярных наблюдаемая картина существенно отлична от рассмотренной. Растворяемое полимерное тело состоит из плотных макромолекулярных клубков, размеры которых значительно больше размеров молекул растворителя. Поэтому процесс растворения начинается с диффузии молекул растворителя в объем растворяемого тела, в результате чего достигается сольватация отдельных сегментов поверхностных макромолекул. Макроскопически это наблюдается как образование на поверхности тела просвечивающего набухшего и увеличившегося в объеме слоя. Сольватация сегментов макромолекулы сопровождается увеличением их локальной подвижности, подобно ому как это реализуется в процессе перехода из стеклообразного состояния в высокоэластическое. При полной сольватации макромолекулы она отделяется от растворяемого полимерного тела и «транспортируется» в объем растворителя в форме сольватированного клубка, основную часть объема которого (более 90%) составляет растворитель. Если сочетание энтальпийного и энтропийного членов уравнения для свободной энергии Гиббса таково, что изменение последней остается отрицательным на протяжении всего процесса, сольватация идет до такого состояния, что полностью сольватированые макромолекулы одна за другой транспортируются в раствор.
∆G = ∆H - T∆S
Как правило, энтропия при растворении возрастает, т.е. ∆Sбольше нуля и энтропийный член уравнения Гиббса «работает» на растворение. Процесс сольватации идет до конца во всем диапазоне концентраций при ∆Hменьше нуля, то есть если процесс экзотермический. Если процесс эндотермический (∆Hбольше нуля), то при равенстве по абсолютным значениям ∆Hи T∆Sизменение свободной энергии Гиббса∆G = 0, что отвечает некоторому равновесию. Для растворов низкомолекулярных веществ это равновесие соответствует образованию насыщенного раствора – сколько молекул или ионов транспортировалось в раствор за единицу времени, столько же их и конденсировалось на поверхности тела. В случае растворения полимеров это равновесие соответствует степени сольватации макромолекулы, недостаточной для перехода ее в раствор – она остается набухшей, но связанной с полимерным телом. При равномерной сольватации тела по всему объему образуется набухшая, но не растворенная система, содержащая в своем объеме значительную долю растворителя. Такая система называется гелем или студнем второго рода. При увеличении температуры возрастает вклад энтропийной составляющей, и равновесие может сместиться вплоть до образования раствора. Примером такой системы может являться «классический» студень, получаемый растворением желатины в горячей воде. Существует и другой механизм формирования гелей. Студни или гели первого рода представляют собой «сшитые» трехмерные системы, не способные образовывать растворы из-за того, что все фрагменты таких систем связаны друг с другом ковалентными связями. Важной характеристикой гелей является степень набухания – отношение объема (или массы) набухшего тела к исходной массе полимерного образца. Гели обоих родов очень широко используются в биомедицинских технологиях, особенно для направленной доставки лекарственных средств.
Дата добавления: 2016-12-09; просмотров: 5151;











