Стандартный водородный электрод
ЭДС элемента равна разности равновесных потенциалов катода и анода. Если потенциал одного из электродов принять равным нулю, то относительный потенциал Е второго элемента будет равен ЭДС элемента. Таким образом, можно определить относительный потенциал любого электрода. В настоящее время известны лишь относительные электродные потенциалы. За нуль принят потенциал стандартного водородного электрода.
Водородный электрод представляет собой Рt - пластинку, покрытую тонким слоем очень рыхлой пористой платины для увеличения её поверхности. Пластинка опускается в 2 н. водный раствор H2SO4 (рис. 62). Активность ионов водорода в таком растворе равна 1 г – ион/л. Через раствор пропускается химически чистый водород под атмосферным давлением. Водород насыщает поверхность Pt - пластины, часть его переходит в атомарное состояние H2 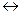 2H и на границе электрода с раствором устанавливается равновесие Н ↔Н+ + ē или 2Н+ + 2ē ↔ Н2.
2H и на границе электрода с раствором устанавливается равновесие Н ↔Н+ + ē или 2Н+ + 2ē ↔ Н2.
Водородный электрод условно обозначают Н2 / 2Н+, где вертикальная черта обозначает поверхность раздела фаз.
Если давление водорода в газовой среде, соприкасающейся с раствором равно 1 атм, активность ионов Н+ в рас-
творе равна 1 г – ион/л , то потенциал такого электрода условно принимается за 0 В и его в этом случае называют нормальным
(стандартным) водородным электродом.
Для определения потенциалов электродов по водородной шкале собирают гальванический элемент, одним из электродов
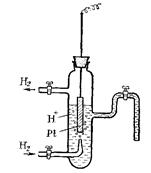
Рис. 62. Схема водородного электрода
которого является измеряемый, а вторым стандартный водородный электрод. Схему такого элемента записывают следующим образом: слева - водородный электрод, справа - измеряемый электрод. Например, схема гальванического элемента для измерения потенциала цинкового электрода имеет вид:
Н2, Pt |H+| |Zn2+| Zn,
а схема для измерения потенциала медного электрода:
H2, Pt |H+| |Cu2+| Cu.
Поскольку потенциал водородного электрода условно принят за нуль, то измеряемая величина ЭДС элемента будет равна потенциалу электрода.
Дата добавления: 2016-12-09; просмотров: 5686;











