Свойства растворов неэлектролитов
Для количественного описания свойств растворов используют модель идеального раствора. Идеальным называют раствор, в котором силы межмолекулярного взаимодействия отдельных компонентов одинаковы и между компонентами нет химического взаимодействия. Образование такого раствора сопровождается нулевым тепловым эффектом (Δ H = 0); каждый компонент ведет себя в идеальном растворе независимо от остальных компонентов, и свойства раствора при данных условиях определяются только концентрацией растворенного вещества. Из реальных растворов лишь разбавленные растворы неэлектролитов могут по своим свойствам приближаться к идеальным.
Давление насыщенного пара над веществом (в жидком или твердом состоянии является его важнейшей характеристикой. Эта характеристика определяет состояние равновесия в процессах испарения (сублимации) и конденсации:
Жидкость испарение
или (сублимация)
 твердое вещество пар
твердое вещество пар 
конденсация
Смещение этих равновесий зависит от термодинамических условий сублимации и подчиняется принципу Ле – Шателье.
По аналогии с чистым веществом давление насыщенного пара над раствором также является важной его характеристикой, определяющей физико - химические свойства.
I закон Рауля. Для двухкомпонентного идеального раствора при данной температуре T давления насыщенных паров чистых компонентов обозначим для растворителя 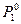 и для растворенного вещества
и для растворенного вещества 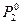
Выразим состав раствора в мольных долях
N1 + N2 = 1;
где N1 - мольная доля растворителя, а N2 - растворенное вещество.
Общее давление P насыщенного пара над раствором, очевидно, слагается из парциальных давлений компонента 1 p1 и компонента 2 p2
P = p1 + p2 (1)
Уравнение (1) математически описывает закон Дальтона, согласно которому давление насыщенного пара над системой равно сумме парциальных давлений компонентов, образующих данную систему.
Парциальное давление компонентов зависит от их количественного соотношения в смеси или от их мольной доли:
p1 = 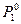 N1, p2 =
N1, p2 = 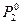 N2 (2)
N2 (2)
Тогда из уравнений (1) и (2) следует:
P = 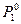 N1 +
N1 + 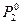 N2 (3)
N2 (3)
Если компонент 2 (растворенное вещество) является нелетучим веществом, то 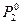 = 0, и поэтому P2 = 0 и уравнение (1) принимает вид:
= 0, и поэтому P2 = 0 и уравнение (1) принимает вид:
P = p1 = 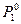 N1 =
N1 = 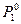 (1 - N2) (4), т.е.
(1 - N2) (4), т.е.
Общее давление насыщенного пара над раствором определяется только парциальным давлением летучего компонента. Уравнение (4) можно привести к виду:
Δ P = 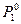 - P =
- P = 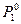 - p1 =
- p1 = 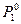 N2 (5)
N2 (5)
где Δ P – понижение давления насыщенного пара над раствором.
Из уравнения (5) следует также, что:
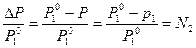 , где
, где
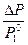 - относительное понижение давления насыщенного пара над раствором.
- относительное понижение давления насыщенного пара над раствором.
Уравнения (1.3), (1.4), (1.5) являются аналитическим выражением первого закона Рауля, который может быть сформулирован: понижение давления насыщенного пара над раствором пропорционально мольной доле растворенного вещества.
 |
Рис. 57. Температуры кипения и кристаллизации
разбавленных растворов
II закон Рауля. Любая жидкость кипит, когда давление ее насыщенного пара достигнет величины внешнего давления. Температура, при которой давление насыщенного пара жидкости равно нормальному давлению (760 мм рт. ст. или 101 325 н / м2) называется температурой кипения. Согласно I закону Рауля давление насыщенного пара растворителя над раствором меньше давления насыщенного пара над чистым растворителем при той же температуре.
Это значит, что при температуре кипения чистого растворителя давление насыщенного пара над раствором нелетучего вещества не достигает нормального давления и раствор кипит при более высокой температуре. Разность между температурами кипения раствора нелетучего вещества и чистого растворителя называется повышением температуры кипения и обозначается ∆ t кип. (рис.1).
При замерзании жидкостей кристаллизация начинается при той температуре, при которой давление насыщенного пара над жидкой фазой становится равным давлению насыщенного пара над твердой фазой. Так, вода замерзает при 00 С потому, что при этой температуре давление насыщенных паров H2O над жидкостью и над льдом одинаково (0,61 кПа). Поскольку при заданной температуре давление насыщенного водяного пара над раствором меньше, чем над чистой водой ( 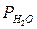 <
< 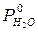 ), то при 00 С значение
), то при 00 С значение 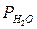 не достигает 0,61 кПа, и раствор при 00 С не замерзает.
не достигает 0,61 кПа, и раствор при 00 С не замерзает.
При более низких температурах давление насыщенных паров H2O над жидкой и твердой фазами становится одним и тем же, раствор замерзает. Температура замерзания раствора тем ниже, чем больше его концентрация.
Для разбавленных растворов малолетучих неэлектролитов повышение температуры кипения ∆ t кип. и понижение температуры замерзания ∆ t зам. не зависят от природы растворенного вещества и прямо пропорциональны концентрации раствора
∆ t кип = Кэ ∙ См; ∆ t зам = Кк ∙ См,
где Кэ и Кк – эбулиоскопическая и криоскопическая константы соответственно; См – моляльность раствора малолетучего неэлектролита.
Физический смысл постоянных Кэ и Кк раскрывается следующим образом. Если в приведенном уравнении принять Ск = 1, ∆ t кип = Кэ, ∆ t кр = Кк, т.е. числовые значения Кэ и Кк показывают, на сколько градусов выше кипел бы и насколько градусов ниже замерзал бы раствор, содержащий 1 моль вещества в 1000 г растворителя по сравнению с температурами кипения и кристаллизации чистого растворителя.
Например, КК = 1,86 для H2O - КЭ = 0,52
Это значит, что водный раствор с одномоляльной концентрацией растворенного вещества (См = 1) начинает кристаллизоваться при 0 – 1,86 = -1,86 0С, а кипеть при 100 + 0,52 = 100,52 0С.
Если раствор состоит из 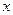 г растворенного вещества с молекулярным весом М и y г растворителя, то моляльная концентрация такого раствора равна:
г растворенного вещества с молекулярным весом М и y г растворителя, то моляльная концентрация такого раствора равна:
m = 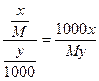
Подставив это значение во II уравнение Рауля, и решив их относительно М, получим значение молекулярного веса растворенного вещества, вычисленного по понижению температуры кристаллизации растворов (криоскопический метод):
М = 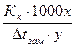 ,
,
или по повышению температуры кипения растворов (эбулиоскопический метод):
М = 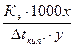 ,
,
Применение – антифризы, холодные растворы; 30 % - ный раствор CaCl2 замерзает при – 550 С.
Осмотическое давление. При соприкосновении раствора с чистым растворителем на границе между ними наблюдается передвижение молекул растворенного вещества в среду чистого растворителя. Этот процесс диффузии обусловлен способностью растворенного вещества равномерно распределяться во всем объеме раствора; одновременно идет и диффузия растворителя в раствор, т.е. происходит процесс выравнивания концентраций.
Диффузия может стать односторонней, если растворы разделить полупроницаемой перегородкой, пропускающей только молекулы растворителя. При условии, что C1 > C2 , молекулы растворителя с большей скоростью будут диффундировать в направлении C2 → C1, и объем раствора с концентрацией C1 несколько возрастет. Такая односторонняя диффузия растворителя через полупроницаемую перегородку называется осмосом. (рис.58).
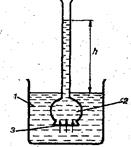
Рис. 58. Схема осмометра
1 – раствор; 2 – вода; 3 – полупроницаемая перегородка.
Столб жидкости с высотой h образовался за счет осмоса. Осмос прекращается тогда, когда скорости перехода молекул растворителя через полупроницаемую перегородку в обоих направлениях становятся одинаковыми.
Для количественной характеристики осмотических свойств растворов по отношению к чистому растворителю вводится понятие об осмотическом давлении, равном силе, приходящейся на единицу площади поверхности и заставляющей проникать молекулы растворителя через полупроницаемую перегородку.
Осмотическое давление Pосм. численно равно гидростатическому давлению столба жидкости высотой h, препятствующему односторонней диффузии растворителя. Величина Pосм. зависит от температуры раствора и его концентрации и не зависит от природы растворителя и растворенного вещества.
Для разбавленных растворов неэлектролитов зависимость осмотического давления от температуры и концентрации выражается уравнением:
Pосм. = CRT, закон Вант – Гоффа (1886 г.)
где С = 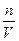 - молярная концентрация;
- молярная концентрация;
R - универсальная газовая постоянная;
T - абсолютная температура.
Это уравнение выводится из уравнения Клайперона – Менделеева:
Pосм. = 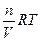
Дата добавления: 2016-12-09; просмотров: 4708;











