Образования ковалентной связи
Рассмотренный механизм возникновения ковалентных связей путем обобщения непарных электронов двух атомов, получил название “обменного механизма”. Образование ковалентной связи может происходить также при взаимодействии одного атома или иона с заполненной атомной орбиталью с другим атомом или ионом, имеющим вакантную (свободную) орбиталь. Такой механизм образования ковалентной связи называется донорно-акцепторным. Атом или ион, поставляющий пару электронов, называется донором, а атом или ион, к которому эта пара электронов перемещается – акцептором. Согласно методу ВС ковалентная связь по донорно-акцепторному механизму возникает при перекрывании орбитали одного атома или иона с заполненными орбиталями донора или донорной группы. Поэтому донорная группа должна содержать по меньшей мере одну неподеленную пару электронов. Например, образование молекулы H2 по донорно-акцепторному механизму можно представить следующим образом:
 |
 H- ¯ + H+→ H ¯ H
H- ¯ + H+→ H ¯ H
 1S - AO первого иона-протона H+ свободна, что условно обозначается
1S - AO первого иона-протона H+ свободна, что условно обозначается
У второго иона (гидрид ион H-) имеется два электрона и его электронная конфигурация 1s2. Ядро гидрид - иона окружает двухэлектронное облако с антипараллельными спинами электронов. При сближении ионов двухэлектронное облако гидрид - иона притягивается к протону и в конечном счете становится общим для обеих ядер водорода, т.е. превращается в двухэлектронное молекулярное облако. В данном примере донор – гидрид-ион H- , акцептор – протон H+
В соответствии с двумя механизмами образования ковалентной связи, рассмотрим валентные возможности атомов бора, углерода и азота. Это элементы второго периода и, следовательно, их валентные электроны распределяются по четырем орбиталям внешнего уровня: одной 2s и трем 2p:
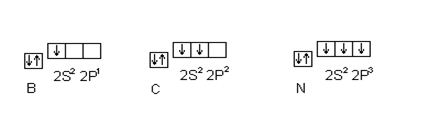
Поскольку у бора и углерода имеются энергетически близкие свободные 2p орбитали, при возбуждении эти элементы могут приобретать новые электронные конфигурации:
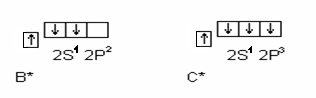
В соответствии с числом непарных электронов атомы B, C и N могут образовывать соответственно 3, 4, 3 ковалентные связи, например с атомами водорода:
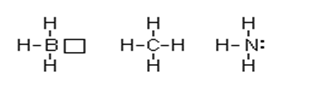
В молекуле BH3 дефицит электронов – атом бора имеет свободную орбиталь. В молекуле же NH3 при атоме азота имеется неподеленная, или, как говорят, несвязывающая электронная пара. Таким образом, молекула BH3 может выступать как акцептор электронной пары, а молекула NH3 – как донор электронной пары. Иными словами, центральные атомы той и другой молекулы способны к образованию четвертой ковалентной связи по донорно-акцепторному механизму. Простей-
ший донор электронной пары – гидрид-ион H-. Присоединение отрицательного гидрид иона к молекуле BH3 приводит к образованию сложного (комплексного) иона BH4- с отрицательным зарядом:
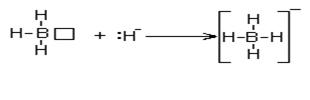
Простейший акцептор электронной пары – протон; его присоединение к молекуле NH3 тоже приводит к образованию комплексного иона NH4+ , но уже с положительным зарядом:
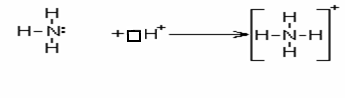
В этих соединениях атомы бора и азота четырехвалентны. Таким образом, валентность элемента в общем случае определяется числом орбиталей, использованных при образовании химической связи. У элементов 2-го периода имеются 4 валентных орбитали, поэтому максимально возможное число ковалентных связей равно четырем. У элементов 3-его и последующих периодов роль валентных могут играть также внешние d- орбитали и f- орбитали.
Дата добавления: 2016-12-09; просмотров: 2885;











