Квантово – механическая теория валентности
Валентность – это способность химического элемента к образованию химических связей. Согласно методу ВС численное значение валентности соответствует числу ковалентных связей, которые образуют атом.
Поскольку пребывание двух электронов с противоположными спинами в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле своего ядра, поэтому в образовании ковалентных связей принимают участие все одноэлектронные облака. Таким образом, согласно обменному механизму метода ВС, валентность элементов определяется числом содержащихся в атоме непарных электронов. Для s- и p- элементов это электроны внешнего уровня, для d- элементов – внешнего и предвнешнего уровней. Например, валентность элементов I A группы равна 1, т.к. на внешнем уровне атомы этих элементов имеют 1 электрон.
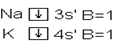
В некоторых случаях число непарных электронов увеличивается в результате возбуждения атома, при котором двухэлектронные облака распадаются на одноэлектронные. Например, валентность элементов II A группы в невозбужденном состоянии равны нулю, а при возбуждении этих атомов p- электроны распариваются и один из электронов переходит в свободную p- ячейку.
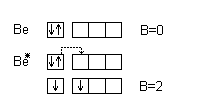
Кислород и фтор во всех соединениях проявляют постоянную валентность, равную двум для кислорода и единицы для фтора. Валентные электроны этих элементов находятся на втором энергетическом уровне, где нет свободных орбиталей:

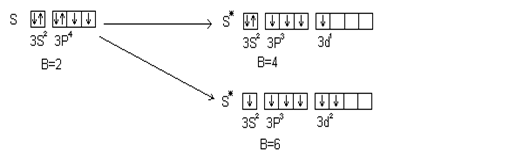
В то же время сера – аналог кислорода – проявляет переменную валентность 2, 4, 6; хлор – аналог фтора – проявляет валентность 1, 3, 5, 7. Это объясняется наличием свободных АО на третьем энергетическом уровне; например у серы.
Для большинства d- элементов валентность в невозбужденном состоянии равна нулю, так как на внешнем уровне непарных электронов. Например, для железа
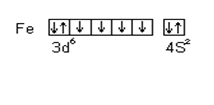
B = 0
При возбуждении атома железа s- электроны разъединяются и переходят на свободный p- подуровень четвертого уровня и валентность становится равной двум.
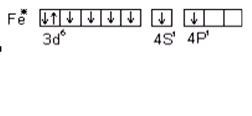
B = 6
Кроме внешних валентными могут быть непарные d- электроны предвнешнего уровня, и валентность атома железа с учетом d- электронов может быть равна 3, 4, 5, а максимально 6. Переход электронов при возбуждении атома возможен лишь внутри одного главного числа. Для перехода электрона с одного уровня на другой требуется очень большая энергия, поэтому такие переходы практически не осуществляются. Например, аналогом железа является осмий, который в отличие от него может проявлять максимальную валентность равную восьми за счет перехода электронов в пределах одного пятого уровня:
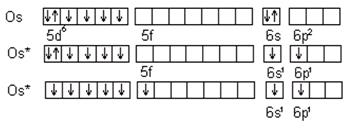 |
B = 8
При возбуждении атома Os s- электроны переходят на свободный p- подуровень шестого уровня, валентность становится равной двум. Неспаренные d- электроны увеличивают ее до шести. Кроме того, спаренные d- электроны имеют возможность разъединяться и переходить на свободный f- подуровень пятого уровня, тогда максимальная валентность осьмия становится равной восьми.
Дата добавления: 2016-12-09; просмотров: 2677;











