Кривая потенциальной энергии
Химическая связь образуется только в том случае, если при сближении атомов (двух или большего числа) полная энергия системы (сумма кинетической и потенциальной энергии) понижается.
Важнейшие сведения о строении молекул дает изучение зависимости потенциальной энергии системы от расстояния между составляющими ее атомами. Впервые эту зависимость изучили в 1927 году немецкие ученые У. Гейтлер и Ф. Лондон, исследуя причины возникновения химической связи в молекуле водорода. Используя уравнение Шредингера, они пришли к выводу, что энергия системы, состоящей в молекуле водорода из двух ядер и двух электронов, может быть выражена следующим образом:
Е = ~ К ± О,
где К – кулоновский интеграл, включающий все электростатические взаимодействия, т.е. отталкивание между электронами, отталкивания между ядрами, а так же притяжение электронов к ядрам атомов. О – обменный интеграл, он характеризует возникновение электронной пары и обусловлен движением электронов вокруг обоих ядер водорода. Этот интеграл имеет очень большое отрицательное значение. Таким образом, по расчетам, энергия данной системы может принимать два значения:
Е = ~К + О и Е = ~К - О
Следовательно, существуют такие состояния электронов, при взаимодействии которых энергия системы может изменяться в пределах 0 < E < 0.
Первое уравнение соответствует уменьшению энергии системы Е < 0.
Второе уравнение соответствует увеличению энергии системы Е > 0.
Условию уменьшения энергии системы удовлетворяет “y”- функция, определяющая состояние взаимодействующих электронов с противоположно направленными (антипараллельными) спинами. Эта “y” - функция называется симметричной “y” - функцией.
Отсюда следует вывод - химическая связь между атомами должна возникать только в том случае, если электроны, принадлежащие различным атомам, имеют противоположно направленные спины. Лишь при этом условии энергия молекулярной системы будет меньше энергии атомных систем, т.е. образуется устойчивая молекула. Следовательно, антипараллельность спинов электронов взаимодействующих атомов является необходимым условием образования ковалентной связи.
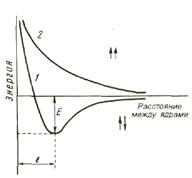 |
Рис. 8. Изменение потенциальной энергии в системе из двух атомов водорода в зависимости от расстояния между ядрами
При сближении двух атомов, если спины электронов параллельны, то суммарная их энергия увеличивается, между атомами возникает и возрастает сила отталкивания (рис.8).
При противоположно направленных спинах сближение атомов до некоторого расстояния r0 сопровождается уменьшением энергии системы.
При r = r0 система обладает наименьшей энергией, т.е. находится в наиболее устойчивом состоянии, характеризующимся образованием молекул водорода Н2. При дальнейшем сближении атомов энергия резко возрастает.
Возникновение молекулы Н2 из атомов можно объяснить перекрыванием атомных электронных облаков с образованием молекулярного облака, которое окружает два положительно заряженных ядра.
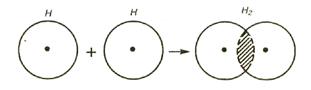 |
Рис. 9. Перекрывание электронных облаков
при образовании молекулы водорода
В месте перекрывания электронных облаков (т.е. в пространстве между ядрами) электронная плотность связующего облака максимальна (рис.9). Иначе говоря, вероятность пребывания электронов в пространстве между ядрами больше, чем в других местах. Благодаря этому возникают силы притяжения между положительным зарядом ядра и отрицательными зарядами электронов и ядра сближаются – расстояние между ядрами водорода в молекуле Н2 заметно меньше (0,74 Å) суммы радиусов двух свободных атомов водорода (1,06 Å)
Связь, образующаяся в результате обобщения электронных плотностей взаимодействующих атомов получила название ковалентной.


 Согласно квантово - механическим представлениям взаимодействие атомов может привести к образованию молекулы только при условии, что спины электронов сближающихся атомов с противоположно направленными спинами. При сближении электронов с параллельными спинами действуют только силы отталкивания.
Согласно квантово - механическим представлениям взаимодействие атомов может привести к образованию молекулы только при условии, что спины электронов сближающихся атомов с противоположно направленными спинами. При сближении электронов с параллельными спинами действуют только силы отталкивания.
Н + Н ¯ →Н ¯ Н → Н2
+1/2 -1/2
Поскольку точное решение уравнения Шредингера для атомно-молекулярных систем невозможно, возникли различные приближенные методы расчета волновой функции, а следовательно распределения электронной плотности в молекуле. Наиболее широкое распространение получили два метода: метод валентных связей (ВС) и метод молекулярных орбиталей (МО). В развитии первого метода особая заслуга принадлежит Гейтлеру и Лондону, Слетеру и Полингу. Развитие второго метода связано в основном с именами Малликена и Хунда.
Основные положения метода ВС.1) Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, при чем эта электронная пара принадлежит двум атомам.
2) При образовании ковалентной связи происходит перекрывание электронных облаков взаимодействующих атомов, в межъядерном пространстве увеличивается электронная плотность, что приводит к уменьшению энергии системы.
3) Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Поэтому ковалентная связь образуется в таком направлении, при котором это перекрытие максимально.
Этот метод дает обоснование обозначению с помощью черточки химической связи в структурных формулах соединений.
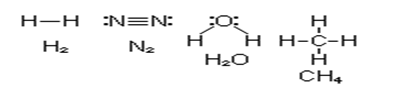
Таким образом, в представлении метода ВС химическая связь локализована между двумя атомами, т.е. она двухцентровая и двухэлектронная.
Дата добавления: 2016-12-09; просмотров: 5434;











