Метод молекулярных орбиталей
Метод валентных связей дает теоретическое обоснование широко применяемым химиками структурным формулам и позволяет правильно определить структуру практически всех соединений s – и p – элементов. Большое достоинство метода в его наглядности. Однако представление о локализованных (двухцентровых, двухэлектронных) химических связях оказывается слишком узким для объяснения многих экспериментальных фактов. В частности, метод валентных связей несостоятелен для описания молекул с нечетным числом электронов, например, H 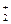 , H
, H  , бораны, некоторые соединения с сопряженными связями, ряд ароматических соединений, карбонилы металлов, т.е. молекулы с дефицитом электронов или их избытком (H
, бораны, некоторые соединения с сопряженными связями, ряд ароматических соединений, карбонилы металлов, т.е. молекулы с дефицитом электронов или их избытком (H  ). Обнаружились непреодолимые трудности использования метода валентных связей для объяснения валентности элементов восьмой группы с фтором и кислородом (XeF6, XeOF4, XeO3 и др.), металлов в ”сэндвичевых” металлоорганических соединениях, например, железа в ферроцене
). Обнаружились непреодолимые трудности использования метода валентных связей для объяснения валентности элементов восьмой группы с фтором и кислородом (XeF6, XeOF4, XeO3 и др.), металлов в ”сэндвичевых” металлоорганических соединениях, например, железа в ферроцене
Fe (C5H5)2, где он должен был бы образовать связи с десятью атомами углерода, не имея такого количества электронов на внешней оболочке.
На основе метода ВС трудно объяснить и то, что отрыв электронов от некоторых молекул приводит к упрочнению химической связи. Так, энергия разрыва связи в молекуле F2 составляет 38 ккал/моль, а в молекулярном ионе F 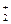 - 76 ккал/моль. Этот метод не объясняет и парамагнетизм молекулярного кислорода O2 и B2.
- 76 ккал/моль. Этот метод не объясняет и парамагнетизм молекулярного кислорода O2 и B2.
Более общим и универсальным оказался метод молекулярных орбиталей (МО), при помощи которого удается объяснить факты, непонятные с позиции метода ВС. Значительный вклад в разработку метода МО внес американский ученый Р. Малликен (1927 – 1929 гг).
Основные понятия. В своей основе метод МО распространяет квантово - механические закономерности, установленные для атома, на более сложную систему - молекулу. В основе метода молекулярных орбиталей лежит представление об ''орбитальном'' строении молекулы, т.е. предположение о том, что все электроны данной молекулы (как и в атоме) распределяются по соответствующим орбиталям. Каждая орбиталь характеризуется набором квантовых чисел, отражающих свойства электрона в данном энергетическом состоянии. Особенность метода МО заключается в том, что в молекуле имеется нескольких атомных ядер, т.е. в отличие от одноцентровых атомных орбиталей молекулярные орбитали несколькоцентровые (общие для двух и большего числа атомных ядер). По аналогии с атомными s -, p -, d -, f - орбиталями молекулярные орбитали обозначаются греческими буквами σ -, π, δ -, φ .
Основная проблема метода МО - нахождение волновых функций, описывающих состояние электронов на молекулярных орбиталях. Согласно одному из вариантов метода молекулярных орбиталей, названным линейной комбинацией атомных орбиталей (МОЛКАО), молекулярные орбитали образуются из атомных путем их линейной комбинации. Пусть электронные орбитали взаимодействующих атомов характеризуются волновыми функциями Ψ1, Ψ2, Ψ3 и т.д. Тогда предполагается, что волновая функция Ψмол, отвечающая молекулярной орбитали, может быть представлена в виде суммы:
Ψмол.= С1Ψ1 + С2Ψ2 + С3Ψ3 + …. .,
где С1, С2, С3 ... некоторые численные коэффициенты. Это уравнение равносильно предположению, что амплитуда молекулярной электронной волны (т.е. молекулярная волновая функция) образуется сложением амплитуд взаимодействующих атомных электронных волн (т. е. сложением атомных волновых функций). При этом, однако, под влиянием силовых полей ядер и электронов соседних атомов волновая функция каждого электрона изменяется по сравнению с исходной волновой функцией этого электрона в изолированном атоме. В методе МОЛКАО эти изменения учитываются введением коэффициентов С1, С2, С3 и т.д.
При построении молекулярных орбиталей по методу МОЛКАО должны соблюдаться определенные условия:
1. Комбинируемые атомные орбитали должны быть близкими по энергии, иначе электрону будет энергетически невыгодно находиться на подуровне с более высокой энергией. (1 s и 5 p не взаимодействуют).
2. Необходимо максимальное перекрывание атомных орбиталей, образующих молекулярную орбиталь.
3. Атомные орбитали, образующие молекулярные орбитали, должны обладать одинаковыми свойствами симметрии относительно межъядерной оси молекулы. (px - электронное облако может комбинироваться только с px облаком, но не py и pz).
Следует также учитывать, что совокупность молекулярных орбиталей молекулы, занятых электронами, представляет ее электронную конфигурацию. Она строится так же как и для атома, на основе принципа наименьшей энергии и принципа Паули.
Для описания электронной конфигурации основного состояния молекулы с 2n или (2n - 1) электронами требуется n молекулярных орбиталей.
Связывающие и разрыхляющие орбитали.Рассмотрим, какой вид будет иметь молекулярная волновая функция Ψм, образованная в результате взаимодействия волновых функций (Ψ1 и Ψ2) 1 s орбиталей двух одинаковых атомов. Для этого найдем сумму С1Ψ1 + С2Ψ2. Поскольку в данном случае атомы одинаковые С1 = С2; они не будут влиять и на характер волновых функций, поэтому ограничимся нахождением суммы Ψ1 + Ψ2.
Для этого расположим ядра взаимодействующих атомов на том расстоянии друг от друга (r), на котором они находятся в молекуле. Вид Ψ функций 1 s орбиталей будет следующим:
 |
 Ψмол
Ψмол
Рис. 22. Схема образования связывающей МО
из атомных 1 s - орбиталей
Чтобы найти молекулярную волновую функцию Ψ, сложим величины Ψ1 и Ψ2. В результате получим следующий вид кривой (рис. 22)
Как видно, в пространстве между ядрами значения молекулярной волновой функции Ψмол. больше, чем значения исходных атомных волновых функций. Но Ψмол. характеризует вероятность нахождения электрона в соответствующей области пространства, т.е. плотность электронного облака.
Возрастание Ψмол. – функции в сравнении с Ψ1 и Ψ2 означает, что при образовании молекулярной орбитали плотность электронного облака в межъядерном пространстве увеличивается, в результате возникают силы притяжения положительно заряженных ядер к этой области – образуется химическая связь. Поэтому молекулярная орбиталь рассматриваемого типа называется связывающей.
В данном случае область повышенной электронной плотности находится вблизи оси связи, так что образовавшаяся МО относится к σ – типу. В соответствии с этим, связывающая МО, полученная в результате взаимодействия двух атомных 1s – орбиталей обозначается σсв.1s. Электроны, находящиеся на связывающей МО, называются связывающими электронами.
При взаимодействии двух атомов знаки волновых функций их 1s – орбиталей могут оказаться различными. Такой случай графически можно представить следующим образом:
 |
Ψмол
Рис. 23. Схема образования разрыхляющей МО
из атомных 1 S – орбиталей
Молекулярная орбиталь (рис. 23), образующаяся при таком взаимодействии, характеризуется уменьшением абсолютной величины волновой функции в межъядерном пространстве по сравнению с ее значением в исходных атомах: на оси связи
появляется даже точка, в которой значение волновой функции, а, следовательно, и ее квадрата, обращается в нуль. Это означает, что в рассматриваемом случае уменьшится и плотность электронного облака в пространстве между атомами. В результате притяжения каждого атомного ядра в направлении к межъядерной области пространства окажется более слабым, чем в противоположном направлении, т.е. возникнут силы, приводящие к взаимному отталкиванию ядер. Здесь, следовательно, химическая связь не возникает; образовавшаяся в этом случае МО называется разрыхляющей (σразр.1s), а находящиеся на ней электроны – разрыхляющими электронами.
 |
Молекулярные орбитали, полученные при сложении и вычитании 1s – атомных орбиталей имеют следующие формы (рис. 24). Взаимодействие, приводящее к образованию связывающей орбитали, сопровождается выделением энергии, поэтому электрон, находящийся на связывающей орбитали, обладает меньшей энергией, чем в исходном атоме.
Рис. 24. Схема образования связывающей и разрыхляющей
молекулярных σ - орбиталей
Образование разрыхляющей орбитали требует затраты энергии. Следовательно, на разрыхляющей орбитали электрон обладает более высокой энергией, чем в исходном атоме.
 |
Двухатомные гомоядерные молекулы элементов первого периода. Образование молекулы водорода H2 по методу МО представляется следующим образом (рис. 25):
Рис. 25. Энергетическая диаграмма образования
молекулярных орбиталей H2
Следовательно, вместо двух энергетически равноценных 1 s – орбиталей (исходные атомы водорода) при образовании молекулы H2 возникают две энергетически неравноценные молекулярные орбитали – связывающая и разрыхляющая.
В этом случае 2 элемента занимают молекулярную орбиталь с более низкой энергией, т.е. σсв 1 s орбиталь.
Реакция образования молекулы H2 в терминах МО может быть записана:
2 H [1 s1] = H2 [ (σ св1 s)2] или
H [1 s1] + H [1 s1] = H2 [(σ св1 s)2]
В молекуле H2 два электрона. Согласно принципу наименьшей энергии и принципу Паули эти два электрона с противоположными спинами также заселяют σ св орбиталь.
Приведенная энергетическая диаграмма молекулярных орбиталей справедлива для двухъядерных образований (элементами первого периода): H2+, He2+ и He2
В молекулярном дигелии – ионе He2+ три электрона, два из которых заселяют связывающую, третий – разрыхляющую орбиталь He2+ [(σсв 1 s)2 (σразр 1 s)] (рис. 26):
 |
Рис. 26. Энергетическая диаграмма образования
молекулярных орбиталей He 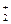
 |
Ион H2+ состоит из двух протонов и одного электрона. Естественно, что единственный электрон этого иона должен занимать энергетически наиболее выгодную орбиталь, т.е. σ св 1s. Таким образом, электронная формула иона H2+ H2 +[( σсв 1s)'] (рис. 27):
Рис. 27. Энергетическая диаграмма образования
молекулярных орбиталей H 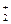
В системе из двух атомов гелия He2 четыре электрона; два на связывающей и два на разрыхляющей орбитали.
Энергия, длина и порядок связи.По характеру распределения электронов по молекулярным орбиталям можно оценить энергию и порядок связи. Как уже было показано, нахождение электрона на связывающей орбитали означает, что электронная плотность концентрируется между ядрами, что обуславливает сокращение межъядерного расстояния и упрочения молекулы. Наоборот электрон на разрыхляющей орбитали означает, что электронная плотность концентрируется за ядрами. В этом случае, следовательно, энергия связывания снижается, а межъядерное расстояние увеличивается, как это показано ниже.

В ряду H2+ - H2 - He2+ по мере заполнения связывающей орбитали, энергия диссоциации молекул возрастает, с появлением же электрона на разрыхляющей МО, наоборот, уменьшается, а затем увеличивается.
Молекула гелия существовать не может в невозбужденном состоянии, так как число связывающих и разрыхляющих электронов у нее одинаково.
Согласно методу МО порядок связи (кратность) (n) оценивается полуразностью числа связывающих и разрыхляющих электронов:
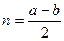 , где
, где
a – число электронов на связывающих орбиталях;
b - число электронов на разрыхляющих орбиталях.
или 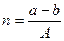 , где А – число атомов в молекуле.
, где А – число атомов в молекуле.
Нетрудно подсчитать, что в молекулярном ионе водорода и дигелии – ионе порядок связи равен 0,5, в молекуле водорода 1, а в системе из двух атомов гелия – нулю.
Двухатомные гомоядерные молекулы элементов второго периода. У элементов 2 – го периода кроме 1 s – орбиталей в образовании МО принимают участие 2s -; 2px - , 2py и 2pz – орбитали.
Комбинация из 2s – орбиталей, как и в случае атомных 1s – орбиталей, соответствует образованию двух молекулярных σ – орбиталей: σсв2s и σразр2s.
Иная картина наблюдается при комбинации орбиталей p – типа. При комбинации атомных 2px – орбиталей, которые вытянуты вдоль оси х, возникают молекулярные σ – орбитали: σсв2px и σразр2px.
При комбинации 2py и 2pz атомных орбиталей образуются πсв2py и πсв2pz, πразр2py и πразр2pz.
Поскольку энергия 2py и 2pz - орбиталей одинакова и перекрываются они одинаковым способом, возникающие πсв2py и πсв2pz – орбитали имеют одинаковую энергию и форму; то же самое относится к πразр2py и πразр2pz – орбиталям. Таким образом, молекулярные π – орбитали составляют πсв и πразр дважды вырожденные энергетические уровни.
Согласно спектроскопическим данным МО двухатомных молекул элементов конца периода по уровню энергии располагаются в следующем порядке:
σсв1s < σразр1s < σсв2s < σразр2s < σсв2px < πсв2py = πсв2pz < πразр2py = πразр2pz < σразр2px
При энергетической близости 2s и 2p – орбиталей электроны на σ 2s и σ 2p – орбиталях взаимно отталкиваются и потому πсв2py и πсв2pz - орбитали оказываются энергетически более выгодными, чем σсв2px орбиталь. В этом случае порядок заполнения молекулярных орбиталей несколько изменяется и соответствует следующей последовательности:
σсв1s < σразр1s < σсв2s < σразр2s < πсв2py = πсв2pz < σсв2px < πразр2py = πразр2pz < σразр2px
Энергетическое различие 2s и 2p – орбиталей в периоде увеличивается от I группы к VIII. Поэтому приведенная последовательность молекулярных орбиталей характерна для двухатомных молекул элементов начала II – го периода вплоть до N2. Так, электронная конфигурация N2. в основном (невозбужденном) состоянии имеет вид:
2N [1s2 2s2 2p3] = N 2 [(σсв1s) 2 (σразр1s) 2 (σсв2s) 2 (σразр2s) 2 * (πсв2py) 2 (πсв2pz) 2 (σсв.2px) 2]
или графически (рис. 28):
АО МО АО
N 1s2 2s2 2p3 N 2 1s2 2s2 2p3
 |
Рис. 28. Энергетическая диаграмма образования
молекулярных орбиталей N2
Характер распределения электронов по молекулярным орбиталям позволяет объяснить также магнитные свойства молекул. По магнитным свойствам различают парамагнитные и диамагнитные вещества. Парамагнитными являются вещества, у которых имеются непарные электроны, у диамагнитных веществ – все электроны парные.
В таблице приведены сведения об энергии, длине и порядке связи гомоядерных молекул элементов начала и конца 2 – ого периода:

В молекуле кислорода имеется два непарных электрона, поэтому она парамагнитна; молекула фтора непарных электронов не имеет, следовательно, она диамагнитна. Парамагнитны также молекула B2 и молекулярные ионы H2+ и He2+, а молекулы С2, N2 и H2 – диамагнитны.
Двухатомные гетероядерные молекулы. Гетероядерные (разноэлементные) двухатомные молекулы описывают методом МОЛКАО, так же как гомоядерные двухатомные молекулы. Однако поскольку речь идет о разных атомах, то энергия атомных орбиталей и их относительный вклад в молекулярные орбитали тоже различны:
Ψ+ = С1 ΨА + С2 ΨB
Ψ- = С3 ΨА + С4 ΨB

|
 |
Рис. 29. Энергетическая диаграмма молекулярных орбиталей гетероядерной молекулы АВ
В связывающую орбиталь больший вклад вносит атомная орбиталь более электроотрицательного атома, а в разрыхляющую – орбиталь менее электроотрицательного элемента (рис. 29). Допустим, атом B электроотрицательнее атома A. Тогда С2 > С1, а С3 > С4.
Различие в энергии исходных атомных орбиталей определяет полярность связи. Величина в является мерой ионности,
а величина a – ковалентности связи.
Диаграмма энергетических уровней гетероядерных двухатомных молекул 2 – го периода аналогична диаграмме гомоядерных молекул 2 – го периода. Например, рассмотрим рас-пределение электронов по орбиталям молекулы CO и ионов CN- и NO+.
Молекула CO и ионы CN-, NO+ изоэлектронны молекуле N2 (содержит по 10 валентных электронов), что соответствует следующей электронной конфигурации в невозбужденном состоянии:

|
(σsсв.)2 (σsразр.)2 (πусв.)2 (πzсв.)2 (σхсв.)2
Энергетическая диаграмма уровней молекулы BeH2 имеет вид: Четыре валентных электрона невозбужденной молекулы BeH2 располагаются на σ  и σ
и σ  - орбиталях, что описывается формулой (σ
- орбиталях, что описывается формулой (σ  ) 2 (σ
) 2 (σ  ) 2.
) 2.
Ионная связь
Химическая связь, возникающая за счет перехода электронов от атома к атому, называется ионной, или электрова-
лентной. Электровалентность определяется числом электронов, теряемых или приобретаемых каждым атомам. Причиной возникновения ионной связи является большая разность ЭО взаимодействующих атомов 2,0 и более. Принципиального различия в механизме возникновения ковалентной и ионной связей нет. Эти виды связи отличаются лишь степенью поляризации электронного облака связи, а, следовательно, длинами диполей и величинами дипольных моментов. Чем меньше разность электроотрицательностей атомов, тем более проявляется ковалентная связь и менее - ионная. Даже в таком ’’идеальном” ионном соединении, как фторид франция, ионная связь составляет около 93- 94 %.
Если рассмотреть соединения элементов какого – либо периода с одним и тем же элементом, то по мере передвижения от начала к концу периода преимущественно ионный характер связи меняется на ковалентный. Например, у фторидов элементов 2 – ого периода в ряду LiF, BeF2, BF3, CF4, NF3, OF2, F2 ионная связь характерная для фторида лития, постепенно ослабевает и переходит в типично ковалентную связь в молекуле фтора.
Для однотипных молекул, например HF, HCl, HBr, HS (или H2O, H2S, H2Se), дипольный момент тем больше, чем больше ЭО элементов (ЭОF > ЭОCl; ЭОО > ЭOS, Se).
Образующиеся ионы можно представить в виде заряженных шаров, силовые поля которых равномерно распределяются во всех направлениях пространства (рис. 30). Каждый ион может притягивать к себе ионы противоположного знака по любому направлению. Иначе говоря, ионная связь в отличие от ковалентной характеризуется ненаправленностью.
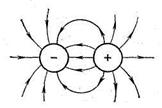
Рис. 30. Распределение электрических силовых
полей двух разноименных ионов
В отличие от ковалентной связи ионная связь характеризуется еще и ненасыщенностью. Объясняется это тем, что образующиеся ионы способны притягивать большое количество ионов противоположного знака. Число притягивающихся ионов определяется относительными размерами взаимодействующих ионов. Вследствие ненаправленности и ненасыщаемости ионной связи, энергетически наиболее выгодно, когда каждый ион окружен максимальным числом ионов противоположного знака. Таким образом, для ионных соединений понятие простых двухионных молекул типа NaCl, CsCl теряет смысл. Ионные соединения в обычных условиях представляют собой кристаллические вещества. Весь кристалл можно рассматривать как гигантскую молекулу, состоящую из ионов Na 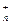 , Cl
, Cl 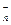 и Cs
и Cs 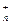 Cl
Cl 
Лишь в газообразном состоянии ионные соединения существуют в виде неассоциированных молекул типа NaCl и CsCl.
Ионная связь, как было показано выше, не является чисто ионной даже в типичных молекулах (CsF, F2F). Неполное разделение зарядов в ионных соединениях объясняется взаимной поляризацией ионов, т.е. влиянием их друг на друга. Поляризуемость – способность к деформации электронных оболочек в электрическом поле.
Это приводит к деформации электронных оболочек ионов. Наибольшее смещение испытывают при поляризации электроны внешнего слоя, поэтому в первом приближении можно считать, что деформации подвергается только внешняя электронная оболочка. Поляризуемость различных ионов неодинакова
Li+ < Na+ < K+ < Rb+ < Cs+

Увеличение R иона, увеличение поляризуемости.
Точно также поляризуемость галогенов изменяется в следующей последовательности:
F- < Cl- < Br- < I-
Увеличение R иона, увеличение поляризуемости.
 Чем меньше заряд иона, тем меньше его поляризуемость. Поляризующая способность ионов, т.е. их способность оказывать деформирующее воздействие на другие ионы зависит от заряда и размера ионов. Чем больше заряд иона и меньше его радиус, тем сильнее создаваемое им электрическое поле, следовательно, тем больше его поляризующая способность. Таким образом, анионы характеризуются (в сравнении с катионами) сильной поляризуемостью и слабой поляризующей способностью.
Чем меньше заряд иона, тем меньше его поляризуемость. Поляризующая способность ионов, т.е. их способность оказывать деформирующее воздействие на другие ионы зависит от заряда и размера ионов. Чем больше заряд иона и меньше его радиус, тем сильнее создаваемое им электрическое поле, следовательно, тем больше его поляризующая способность. Таким образом, анионы характеризуются (в сравнении с катионами) сильной поляризуемостью и слабой поляризующей способностью.
Рис. 31. Смещение электронного облака аниона
в результате поляризации
Под действием электрических полей каждого иона внешняя электронная оболочка смещается в сторону противоположно заряженного иона. Действие электрических полей смещает и ядра атомов в противоположных направлениях. Под действием электрического поля катиона внешнее электронное облако аниона смещается. Происходит как бы обратный перенос части электронного заряда от аниона к катиону (рис. 31).
Таким образом, в результате поляризации электронные облака катиона и аниона оказываются не полностью разделенными и частично перекрываются, связь из чисто ионной превращается в сильнополярную ковалентную. Следовательно, ионная связь – предельный случай полярной ковалентной связи. Поляризация ионов оказывает заметное влияние на свойства образуемых ими соединений. Поскольку с усилением поляризации возрастает степень ковалентности связи, то это сказывается на диссоциации солей в водных растворах. Так, хлорид BaCl2 принадлежит к сильным электролитам и в водных растворах практически полностью распадается на ионы, тогда как хлорид ртути HgCl2 почти не диссоциирует на ионы. Это объясняется сильным поляризующим действием иона Hg2+ радиус которого (1,1 Аº) заметно меньше радиуса иона Ba2+ (1,34 Аº)
Особенно высоким поляризующим действием обладает ион водорода, который может сближаться с анионом до близкого расстояния, внедряясь в его электронную оболочку и вызывая сильную ее деформацию. Так, радиус Cl- равен 1,81 Аº , а расстояние между ядрами атомов хлора и водорода в HCl – 1,27 Аº.
Водородная связь
Общие понятия. Водородная связь – разновидность донорно – акцепторной связи, осуществляющаяся между молекулами различных веществ, в состав которых входит водород. Если молекулу такого вещества обозначить НХ, то взаимодействие за счет водородной связи можно выразить так
Н – Х….. Н – Х….. Н – Х
В качестве х можно взять атомы F, O, N, Cl, S и др. Точечным пунктиром обозначена водородная связь.
В молекулах НХ атом H ковалентно соединен с электроотрицательным элементом, общая электронная пара значительно смещена к электроотрицательному элементу. Водородный атом оказывается протонированным (H+) и он имеет свободную орбиталь.
Анион электроотрицательного элемента другой молекулы НХ имеет неподеленную пару электронов, за счет которых происходит взаимодействие. Если водородная связь образуется между разными молекулами, то она называется межмолекулярной, если связь образуется между двумя группами одной и той же молекулы, то она называется внутримолекулярной. Образование водородной связи наблюдается в растворах НF, H2O (жидк.), NH3 (жидк.), спиртах, органических кислотах и др.
Энергия и длина водородной связи.Водородная связь отличается от ковалентной меньшей прочностью. Энергия водородной связи невелика и достигает 20 – 42 кДж/моль. Она зависит от электроотрицательности (ЭО) и размеров атомов Х: энергия возрастает с увеличением ЭО и уменьшением их размеров. Длина ковалентной связи заметно меньше длины водородной связи (l св.H), например, l св. (F - H) = 0, 092 нм, а lсв.H (F … H) = 0, 14 нм. У воды lсв. (O - H) = 0, 096 нм, а lсв.H (O … H) = 0, 177 нм.
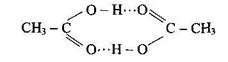
|
Влияние водородных связей на свойства веществ.При возникновении водородных связей образуются димеры, тримеры или полимерные структуры, например зигзагообразные структуры (HF)n, кольцевые структуры некоторых органических кислот, например уксусной кислоты

|
или более сложные конфигурации, например у льда, у которого молекулы воды образуют по четыре водородные связи
Соответственно в жидком состоянии молекулы, вступающие в водородные связи, ассоциированы, а в твердом состоянии образуют сложные кристаллические структуры.
При образовании водородных связей существенно изменяются свойства веществ: повышаются температура кипения и плавления, вязкость, теплоты плавления и парообразования. например, вода, фтороводород и аммиак имеют аномально высокие температуры кипения и плавления.
Вещества в парообразном состоянии проявляют водородную связь в незначительной степени, т.к. с повышением температуры энергия водородной связи уменьшается.
Дата добавления: 2016-12-09; просмотров: 7506;











