Законы М.С. Вревского
График, изображенный на рис.3.43., построен для изобарических условий. При изменении давления в системе изменяется и положение кривой равновесия. Законы, управляющие изменением равновесия при изменении давления в системе, установлены М.С. Вревским:
1. При повышении температуры кипения (давления) раствора двух жидкостей в парах возрастает относительное содержание того компонента, испарение которого требует большей затраты энергии.
2. При повышении температуры азеотропной смеси, обладающей максимумом давления пара, в смеси увеличивается содержание того компонента, парциальная мольная теплота испарения которого больше, а для смеси с минимумом давления пара – содержание компонента – парциальная мольная теплота испарения которого меньше.
Эти законы указывают направление, в котором сдвигается равновесие при изменении давления в системе.
Понятие о дефлегмации
При образовании пара из жидкой бинарной смеси пары обогащаются низкокипящим компонентом. Рассмотрим обратный процесс – конденсацию паров, содержащих два компонента.
Как это видно из диаграммы равновесия (рис.3.43.), пар, содержащий b (%) низкокипящего компонента, находится в равновесии с жидкостью, содержащей a (%) низкокипящего компонента (НК). Поэтому при частичной конденсации этого пара оставшаяся паровая фаза обогащается низкокипящим компонентом. Такая частичная конденсация, сопровождающаяся изменением состава фаз, называется дефлегмацией. Следовательно, дефлегмацией называется конденсация паровой смеси, сопровождающаяся обогащением оставшейся паровой фазы низкокипящим компонентом. Образующаяся при этом жидкая фаза называется флегмой.
Простая перегонка
Перегонку проводят путем постепенного испарения жидкости, находящейся в перегонном кубе. Образующиеся пары отводятся и конденсируются. Если простая перегонка проводится периодически, то в ходе отгонки НК содержание его в кубовой жидкости уменьшается. Вместе с тем, изменяется во времени и состав дистиллята, который обедняется НКпо мере протекания процесса. В связи с этим отбирают несколько фракций дистиллята, имеющих разный состав. Простая перегонка, проводимая с получением конечного продукта разного состава, называется фракционной или дробной перегонкой.
 В периодически действующей установке для фракционной перегонки (рис.3.44.) исходную смесь загружают в перегонный куб 1, снабженный змеевиком для нагревания смеси до кипения. Пары отводятся в конденсатор-холо-дильник 2. Фракции дистиллята поступают в отдельные сборники 3. По окончании операции остаток из куба сливают и загружают вновь разделяемую смесь.
В периодически действующей установке для фракционной перегонки (рис.3.44.) исходную смесь загружают в перегонный куб 1, снабженный змеевиком для нагревания смеси до кипения. Пары отводятся в конденсатор-холо-дильник 2. Фракции дистиллята поступают в отдельные сборники 3. По окончании операции остаток из куба сливают и загружают вновь разделяемую смесь.
Для составления материального баланса простой перегонки необходимо ввести следующие обозначения:
L – количество перегоняемой смеси в кубе в данный момент времени, кг
x - концентрация низкокипящего компонента в разделяемой смеси.
Тогда количество НК в жидкой фазе будет равно: L x.
Пусть за бесконечно малый промежуток времени dt испарится dL кг смеси и концентрация жидкости в кубе уменьшится на величину dx. При этом образуется dL кг пара, равновесного с жидкостью и имеющего концентрацию y*. Количество НК в паре будет равно dLy*. Тогда остаток жидкости в кубе составит (L – dL), кг, а ее концентрация будет (x – dx).
Тогда уравнение материального баланса по НК запишется:
L x =(L – dL) (x – dx) + dLy*.(3-69)
Расчет простой перегонки имеет целью определить количество исходной смеси, которое необходимо перегнать, чтобы получить в кубе остаток заданного состава и дистиллят требуемого состава xср. Средний состав xср получаемого дистиллята рассчитывают из уравнения материального баланса по НК:
F xF=WxW+(F-W)xср,(3-70)
откуда
xср=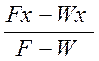 .(3-71)
.(3-71)
Простую перегонку проводят при атмосферном давлении и под вакуумом для снижения температуры кипения смеси.
Дата добавления: 2016-11-29; просмотров: 2426;











