ЛИПОИДЫ С ДРУГИМИ ОТРИЦАТЕЛЬНЫМИ ПОЛЯРНЫМИ ГРУППАМИ
Липоальдегиды: В гомологичном ряду алифатических альдегидов липоидические свойства появляются у пропанала, имеющего в качестве полярной группы карбонил. Из-за карбонила, менее диссоциированного чем карбоксил, липоальдегиды представляют отрицательные липоиды, способные действовать дольше, чем соответствующие кислоты. Нас особенно заинтересовали три группы альдегидов. В одной, имеющей ненасыщенную короткую неполярную цепь, мы искали конъюгированное образование между двойной связью кислорода карбонила и двойной связью неполярной цепи. Вторая группа липоальдегидов соответствовала длинной цепи жирных кислот, в то время как третья формировалась за счет насыщенных альдегидов с короткой цепью с нечетным числом атомов углерода. С точки зрения энергетики, наибольший интерес вызывали первая и, особенно, третья группа. В последней из указанных групп, противоположное влияние, оказываемое карбониловой и метиловой группами на промежуточный атомы углерода цепи, придает молекуле в целом особенно высокую реактивность. Указанное противоположное влияние видно в максимальном выражении у пропанала, где C2 испытывает противоположное влияние карбониловой и метиловой групп. Тот факт, что вследствие его высокой растворимости в воде пропанал, являющийся липоидом, может назначаться в водном растворе, оставаясь в системе липоидов, делает его особенно интересным агентом.
Мы исследовали указанные группы липоальдегидов с точки зрения их влияния, оказываемого на два дисбаланса. В группе с ненасыщенными короткими цепями мы изучали акролеин, кротоновый и малоновый альдегиды и не обнаружили никакого особого воздействия на иные уровни, кроме клеточного, в котором была получена вакуолизация. Более того, помеху представляла их токсичность. Больший интерес вызвала группа насыщенных коротких молекул с нечетным числом углеродных атомов. В то время как гептанал, который мы получили, кроме влияния на боль, также демонстрировал угнетающее действие на рост экспериментальных опухолей, наиболее интересные эффекты в отношении боли показало применение альдегида пропиона.
Это было показано в отношении группы альдегидов с алифатической насыщенной цепью, таких как пропионовый и гептиловый альдегиды или циклическими, в качестве салициловых альдегидов. Для получение заметного влияния на системное состояние и боль адекватными считали дозы от 1/20 см3 до 2 см3 10% раствора пропионового альдегида или 1% раствора гептилового или салицилового альдегидов. Пациенты с дисбалансом А, страдающие от боли и общего дискомфорта, как было показано, испытывали облегчение симптомов после назначения пропионового альдегида. Воздействие на опухоли было уменьшено, и пропионовый альдегид не изменял развитие опухолей, несмотря на заметное улучшение общего состояния и даже прекращение боли.
Липоиды с тиоловыми группами
Меркаптаны: В соответствии с систематизацией представленных выше липоидов, тиоловая группа, действующая в качестве полярной, образует липоид при соединении с энергетически предпочтительной алифатической или циклической неполярной группой. В гомологичном ряду меркаптанов, даже низшие члены являются липоидами, из-за слабых электростатических сил тиоловой группы.
Хотя метилмеркаптан является липоидом, в соответствии с нашей классификацией, указанное вещество слишком летучее, чтобы использоваться. Поэтому первым низшим членом указанного гомологичного ряда, подвергшимся исследованию, был этилмеркаптан.
Эффекты этилмеркаптана на микробы были менее выраженными, если сравнивать таковые от применения жирных кислот. Для выявления эффектов на разных уровнях организации этилмеркаптан требовалось назначать парентерально.
Как и для всех иных членов указанного ряда, мы использовали этилмеркаптан в 5 или 10% масляном растворе масла хлопчатника. В тестах острой токсичности установленная летальная доза составила 145 мг/lOO г веса тела для мышей и 153 мг/lOO г для крыс. Непосредственное действие на ядро было идентичным таковому, но менее интенсивным, чем полученное при использовании препаратов конъюгированных жирных кислот, ведущих к кариорексису или пикнозу в измененных клетках. В органах с высокой митотической активностью, таких как слизистая оболочка кишечника или костный мозг, измененный митоз отмечен не было, хотя в опухолях животных в митозе изменения были заметны. Вторичное действие, усугубление процессов старения, впервые было отмечено несколькими днями после назначения, в виде изменений гранулоцитов в месте инъекции. Среднее число ядерных долей лейкоцитов часто было очень высоким, даже более семи. Указанное явление также отмечено в лейкоцитах циркулирующей крови при внутрибрюшинной или даже подкожной инъекции вещества крысам. Непосредственное влияние подобных инъекций состояло в продленной лейкопении, особенно лимфопении.
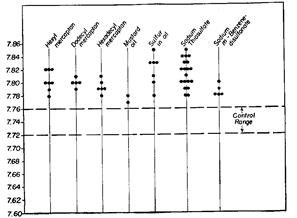
РИС. 125. рН струпа раны второго дня демонстрирует постоянное изменение, по направлению к более щелочным значениям для всех веществ, имеющих в своей полярной группе серу.
При лечении меркаптанами содержание хлорида в опухолях и ранах было особенно повышено. На тканевом уровне был повышен рН струпа раны второго дня, что характерно для действия всех липоидов с сульфгидрилом в качестве полярной группы. (Рис. 125) Это объясняет прямые эффекты метилмеркаптана на боль и другие щелочные, или кислотные, симптомы. Указанные воздействия качественно идентичны таковым, наблюдаемым при использовании полиненасыщенных жирных кислот, но более медленно проявляющимся. В то время как препараты жирных кислот плаценты, например, оказывают воздействие на боль—увеличение интенсивности для щелочной модели и уменьшение для кислотной модели—даже в течение 5-8 минут после назначения парентерально, эффект меркаптанов менее выражен и проявляется через полчаса или позже.
Воздействие на опухоли животных было особенно наглядным в отношении саркомы, исходно индуцированной бензпиреном в наших лабораториях и пассированной на протяжении многих лет через последовательные трансплантации. За указанный период времени опухоль демонстрировала 100% положительную приживаемость, ей был свойственен большой размер, иногда приближавшийся к размеру самого животного, а также отсутствие спонтанного регресса или некротических областей. Были отмечены интересные изменения после проведения подкожных инъекций в ежедневной дозе 1/2 см3 5% раствора в масле хлопчатника у животных с указанными опухолями. Если опухоли уже достигали большого размера, например более 6 см в диаметре, только часть из них подвергалась регрессу (5/20 для опухолей диаметром 6 см). В опухолях, у которых регресса не отмечено, развивались большие области некроза с последующим изъязвлением. Многие становились инфицированными, приводя к смерти. Опухоли размерами менее 6 см в диаметре часто быстро подвергались регрессу и затем исчезали (между 9/20 и 20/20 в разных экспериментах). Подобных поразительных результатов не отмечено ни в одной из линий опухолей крыс или мышей, леченных этилмеркаптаном, хотя у некоторых происходила остановка роста, или появлялись области некроза. Этимеркаптан, введенный в сами опухоли путем инъекции, индуцировал идентичные некротические изменения у большинства животных. (Рис. 126)
Показательным было воздействие на лимфатические органы. У животных, леченных в течение нескольких дней меркаптаном, селезенка, вилочковая железа и лимфоузлы подвергались инволюции. Непостоянным было воздействие на судороги. Судороги предупреждались в некоторых случаях и при использовании малых доз, но обычно эффект был менее постоянным, чем при использовании жирных кислот. У животных и пациентов, леченных указанным веществом, быстро уменьшалось число эозинофилов. Назначение меркаптана влияло на все данные анализа мочи с изменениями, характерными для модели дисбаланса типа D.
Из-за очень неприятного запаха этилмеркаптана мы вынуждены были прекратить его использование, так что его воздействие на некоторые показатели анализа, такие как поверхностное натяжение, экскрецию сульфгидрила и кальция, у пациентов не могло быть изучено.
Другие меркаптаны: Применялись высшие гомологи меркаптанового ряда. Они были разделены на три группы. Первая из них включала пропил-, бутил-, арнил и гексилмеркаптаны; вторая, гептил и аллилмеркаптаны; третья, члены с более чем десятью атомами углерода. Первая группа давала, главным образом, одинаковые эффекты, имевшие тенденцию к уменьшению с увеличением числа атомов углерода.
Например, эффекты были сравнительно менее выражены при использовании гексилмеркаптана по сравнению с этилмеркаптаном. Вторая группа—гептил- и аллилмеркаптаны—давали более интенсивные эффекты. Особенно это касается последних. Члены третьей группы, с более длинными цепями атомов углерода, такие как додецил- и гексадецилмеркаптаны, давали эффекты столь слабо выраженные, что они казались почти несущественными, за исключением воздействия на рН струпа раны второго дня, который демонстрировал значения, очень превышающие контрольные, что справедливо и для других членов указанного гомологичного ряда.
Мы изучили ряд других веществ, собираясь использовать тиол в качестве полярной группы, а в качестве вторичного центра - другой центр молекулы. Одно из них представлял димеркаптопропанол (препарат ВA L), часто используемый при отравлении тяжелыми металлами. Он, как оказалось, совершенно не воздействует на боль, рост опухоли и системные изменения. Его активность уступает таковой высших меркаптанов, которые сами по себе были менее активны, чем полиненасыщенные и измененные жирные кислоты.
Трудности, встретившиеся при назначении меркаптанов, были связаны главным образом с отвратительным запахом низших членов и неактивностью менее неприятных членов. Это побудило нас к поиску иных химических агентов, которые были бы активны и не обладали тяжелым запахом. Было предпринято широкое исследование разных препаратов, которые, как оказалось, имели двухвалентную серную связь в неполярной группе. Мы исследовали коллоидную серу, которая при введении в организм, казалось, претерпевает изменения, подобные тем, что происходят с двухвалентной серой. Таким образом, мы установили, что сера, абсорбированная после ее назначения в коллоидной форме, была почти полностью элиминирована после окисления в форме сульфатов. У животных не было отмечено никаких фармакодинамических воздействий. Лишь увеличивался рН струпа раны второго дня при назначении указанных препаратов парентерально в суспензии или перорально в смеси с пищей в пропорции до 4%. Ни у животных, ни у пациентов заметного изменения развития опухоли не отмечено.
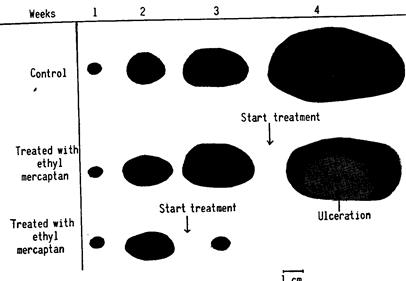
РИС. 126. Влияние, оказываемое этилмеркаптаном на саркому, индуцированную бензпиреном. При больших опухолях воздействие постоянно выражалось в изъязвлении, в то время как для малых опухолей - в их исчезновении.
Гидроперсульфиды
Было испытано другое соединение серы, так называемое "обработанное серой масло", в котором сера и жирные кислоты, как оказалось, образуют гидроперсульфид, (Заметка 7). Указанный препарат гидроперсульфида, хотя и не оказывал влияния на вирусы in vitro, демонстрировал хорошо выраженную местную сопротивляемость кожи в отношении оспенной инфекции. Эффекты в отношении микробов были невыраженными. Отмечалось слабо выраженное непосредственное влияние на клетки. Указанные препараты с 0.5 - 1% серы, связанной с маслом хлопчатника, отличались хорошей местной переносимостью при внутримышечном или интраперитонеальном назначении.
Воздействие, парентерально или перорально вводимого, гидроперсульфида на боль проявлялось медленно, в отличие от эффекта жирных кислот и, даже, меркаптанов. Тем не менее, эффект персистировал долгое время. Боль кислотной модели шла на убыль, а боль щелочной модели усиливалась. Было заметно влияние на рН струпа раны второго дня. Величина местного pH увеличилась до значений даже выше 7.80. При лучевых поражениях размеры изъязвления увеличивались, заживление задерживалось, или даже прекращалось. При некоторых опухолях животных темп роста замедлялся. Этот последний эффект не был одинаковым при исследованных опухолях разных типов и даже в одном виде опухоли в разных группах животных. Системные изменения также варьировали. Дозы, соответствующие 5 мг серы, оказались нетоксичными для мышей весом 30 г, при однократной инъекции, также как и доза 15 мг для крыс весом 200 г. Изучение хронической токсичности показало, что ежедневные инъекции, по 0.2 мг у мышей и по 5 мг у крыс, на протяжении трех месяцев, не вызывали патологических изменений. Высокие дозы, такие как 1-2 см3 1 % препарата, вводимые путем инъекции несколько раз в день у людей почти всегда вызывали подъем температуры, обычно, через несколько дней.
Другие соединения с тиоловой группой
Результаты, полученные с препаратами гидроперсульфида, побудили нас к поиску других соединений с серой, связанной с жирными кислотами вместо триглицеридов, как у тех, которые рассматривали ранее.
Соединения серы готовили из разных конъюгированных жирных кислот, таких как конъюгированные линоленовая, элеостеариновая кислоты и из смесей конъюгированных жирных кислот, полученных из жира печени трески, человеческой плаценты, крови и разных органов. Проявляя активность в меньших количествах, они качественно не отличались от препаратов гидроперсульфида, полученных из масла хлопчатника, давая одинаковые фармакологические эффекты в большинстве тестов, особенно в отношении боли, системных проявлений и развития экспериментальных опухолей.
То, что сера, связанная с неполярной группой, как в гидроперсульфидах, давала менее впечатляющие результаты у животных и человека, чем меркаптаны, имеющие в качестве полярной группы тиоловую, побудило нас изучить другие вещества, в которых на одинаковые позиции были добавлены тиоловые радикалы вместо серы, и затем рассматривались действующими в качестве вторичных энергетических групп. Был получен ряд препаратов, в которых одна или более тиоловых групп были фиксированы к атомам углерода двойной связью в разных конъюгированных или неконъюгированных полиненасыщеных жирных кислотах. Указанные вещества фундаментальным образом отличались от жирных кислот, рассмотренных выше, в которых атомы серы были фиксированы не к атомам углерода, связанным двойными связями, а к углероду, соседствующему с двойной связью. Были получены 9-10, дитиостеариновая кислота, 9, 10, 12, 13, тетратиостеариновая кислота, также как и полиненасыщенные и конъюгированные жирные кислоты с тиоловыми группами, фиксированными к их двойным связям. В общем, они не обнаруживали заметных биологических эффектов в отношении животных, не влияли на боль или системные модели, как это свойственно иным липидам с двухвалентной серой.
Группа гидроперсульфида была добавлена к мылам. Натриевые и аммониевые мыла были получены путем омыления триглицеридов жирных кислот, на которых сера уже была фиксирована. Эффекты на разных уровнях организации были заметно уменьшены. Не отмечалось влияния на боль, органные или системные проявления. Тем не менее поразительный эффект был отмечен в отношении многих микробов. В некоторых экспериментах был предотвращен рост Вас. anthracis, даже в разведениях 1/2,000,000. Для Staphylococcus aureus и Streptococcus hemolyticus, получен идентичный эффект в разведениях выше чем 1/200,000. У животных даже пероральное назначение в питьевой воде в разведении 1/500 и, в некоторых экспериментах, даже 1/1000, предотвращало развитие инфекции, вызванной указанными микробами.
Указанная антимикробная активность оказалась идентичной таковой пенициллина. (Заметка 8)
Персульфиды тетрагидронафталина (обработанный серой тетралин)
Мы использовали известную заметную тенденцию тетрагидронафталина присоединять кислород с образованием взрывчатых перекисей, присоединять серу в подобных соединениях. Персульфиды этого вещества были, таким образом, получены и их фармакологическая активность изучена. Хотя было установлено лишь ограниченное воздействие в отношении вирусов и микробов, влияние на tetrahymena pyriformis напоминало таковое активных полиненасыщенных жирных кислот. Продукт соединения 5 г серы со 100 г тетрагидронафталена обнаруживал относительно низкую активность у нормальных животных - хорошо переносились при внутрибрюшинном назначении 75 мг/100 г у мышей и 125 мг/100 г у крыс. Влияние на заживление ран у животных, на боль, системные анализы у человека было таким же, что и у меркаптанов. Хотя непосредственное влияние на боль было ограниченным, продленное назначение отличалось эффективностью. Наибольшей демонстративностью отличались поверхностное натяжение мочи и калий крови. Токсичность была очень повышена для животных с асцитными опухолями (Sa 180, Ehrlich и Krebs). Тем не менее, влияние, оказываемое на пересаженные и спонтанные опухоли у животных было одним из наиболее благоприятных, если сравнить с воздействием других протестированных агентов.
Тиосульфаты
Мы исследовали тиосульфаты с целью изучения агентов, которые, в дополнение к демонстративному редукционному эффекту, будут воздействовать через двухвалентную серу, освобождающуюся в организме Уничтожение части серы тиосульфатов, в виде меркаптуриновой кислоты, привело к предположению, что ион двухвалентной серы, отделенный от иона тиосульфата, будет воздействовать через комбинации, подобные таковым, обнаруживаемым в метаболизме тиолипоидов.Мы исследовали биологическую активность тиосульфата в том же специфическом аспекте, что и липидные серные соединения, рассмотренные выше, хотя они обладали косвенным влиянием, хотя и не были водоростворимыми и не были непосредственно связаны с липоидами.
Отмечен весьма ограниченный эффект в отношении микробов и вирусов, отсутствие эффекта в отношении фагов и отсутствие изменений восприимчивости кролей по отношению к вирусу оспы. Отмечен демонстративный непосредственный эффект в отношении боли, как при парентеральном, так и при пероральном назначении. Пероральное назначение 1/2 см3 10% раствора тиосульфата натрия в воде или внутримышечная инъекция 1/2 см3 4% раствора обычно сопровождалось определенным воздействием на боль менее чем через 10 минут.
Поскольку это противоречило двум моделям боли, тиосульфат натрия был даже использован для диагностики модели боли. Боль щелочной модели возрастала, в то время как боль кислотной модели уменьшалась. При использовании указанного вещества заметно увеличивалась рН струпа раны второго дня.
Клеточные и ядерные изменения, следующие вслед назначению препаратов тиосульфата, были идентичны таковым, производимым меркаптанами. Воздействия на лимфатическую систему и регенерацию печени, тем не менее, были минимальными. Судороги, вызванные тиамином, поддавались излечению тиосульфатом в дозе 120 мг на 100 г веса тела. Вводимый путем инъекции одновременно с назначением тиамина, тиосульфат предотвращал судороги у большей части животных (17/20).
Воздействие на лучевые поражения были менее демонстративными. Увеличение размеров раны и более долгое течение процесса изъязвления происходили лишь при использовании ежедневно относительно больших количеств тиосульфата натрия. Для получения указанных эффектов были необходимы дозы выше 40 мг/ЮО г веса тела. Заживление простой раны задерживалось только при больших дозах, около 50 мг/lOO г веса тела. С другой стороны, при назначении очень малых доз, таких как 5 мг/lOO г, заживляющее воздействие увеличивалось. У животных противоопухолевые эффекты были менее демонстративными. Слабые и непостоянные изменения наблюдались в отношении пересаженных опухолей. Очень часто в одной и той же экспериментальной группе у некоторых животных опухоли исчезали, в то время как у других темп роста только замедлялся или оставался неизменным. Неустойчивый характер результатов воздействия на опухоли животных тиосульфата повторяли таковые, наблюдавшиеся со многими препаратами серы и были характерны для указанной группы. Повторные инъекции тиосульфатов в опухоли, как было показано, индуцировали исчезновение опухоли, если рост был настолько медленным, что позволял выполнять подобные инъекции на протяжении нескольких недель. На системном уровне наиболее заметное влияние, не такое как на сульфгидрильный индекс, оказывалось на поверхностное натяжение, которое обычно падало с назначением достаточно большого количества.
Большая часть исследований тиосульфата была проведена с солями натрия. В нескольких случаях очень высокие дозы, такие как 6-10 г ежедневно, приводили к формированию лунообразного лица и легкой отечности ног, очевидно связанных с задержкой натрия. Указанные осложнения уходили при прекращении медикаментозного лечения.
Изменение катиона тиосульфата с натрия на магний, как было показано, приводило к росту, иногда заметному, результатов, полученных в наших экспериментах. Кажется, тиосульфат калия является более эффективным, особенно в отношении к боли. Его применение, однако, сдерживалось одним недостатком. При парентеральном назначении он вызывает определенную местную боль в месте выполнения инъекции, как и многие калиевые соли. При назначении пациенту, имеющему боль или другие симптомы щелочной модели или системные проявления, соответствующие типу
D, происходит более заметное увеличение интенсивности симптомов, чем при использовании натриевых или магниевых солей.
Мы также исследовали тетратионат натрия. Кроме более низких требований по дозировке, иных преимуществ его использования не установлено. Его недостатком является относительная нестабильность.
Альфатиожирные кислоты
В других исследованиях мы старались ввести серу в молекулу жирной кислоты, в этот раз, меняя саму полярную группу. При замещении сульфгидрилом гидроксила карбоксильной группы, вводили двухвалентную отрицательную серу, образуя, таким образом, тионическую группу. (R-COSH)
Мы подготовили несколько членов указанного ряда тионической кислоты, соответствующих разным насыщенным, полиненасыщенным и даже конъюгированным жирным кислотам. Особенно мы изучали эффект гексилтионической кислоты, соответствующей капроновой кислоте. Наблюдавшиеся результаты были, по сути, теми же, что и с иными липоидами, содержащими серу, о которых говорилось ранее. Гексилтионическая кислота, в дополнение к влиянию на боль и системные изменения, вызывала ряд интересных эффектов на экспериментальные опухоли, уменьшая рост некоторых из них. Тем не менее, важных отличий от эффектов других сульфолипоидов не было.
Еще один полный ряд продуктов был подготовлен путем введения тиоловой группы в позициюC2, или альфа позицию, разных жирных кислот, с целью создания более сложной полярной группы, подобной той, что имеется в альфагидрокси или альфаамино соединениях. Таким образом, были получены альфатиожирные кислоты для полного гомологического ряда насыщенных и многих ненасыщенных жирных кислот. Некоторые члены указанного ряда альфатиожирных кислот, такие как капроновая, каприловая и миристиновая, были изучены широко, как у животных, так и у человека. Тем не менее, с биологической точки зрения они не обнаруживали демонстративных отличий от ранее обсуждавшихся тиолипоидов.
Тиогликолический ряд
Указанные исследования принесли ограниченные биологические результаты, что побудило нас изучить липоиды, в которых тиол представляет полярную группу, но в которой вторичный полярный центр присутствует в молекуле. Многие подобные синтетические тиолипоиды были подготовлены в нашей лаборатории с надеждой на то, что они докажут большую биологическую эффективность и будут также обладать алкилирующей активностью. Оказались интересными два ряда, поскольку они были особенно активными на низших уровнях организации. Это побудило нас применить их также в большем масштабе в клинической работе. В то время как устойчивые результаты были получены относительно боли и системных изменений, влияние на опухоли животных было слабым и не отличимым от иных препаратов,
имеющих тиоловые группы или соединения серы, о которых говорилось выше. У некоторых животных с опухолями были заметные эффекты, у других с этой же опухолью, леченных идентично, не было никакого эффекта. У людей воздействие на боль, тканевой, органный и системный уровни были идентичны таковым многих других сульфолипоидов.
Начиная с указанных веществ, готовились производные. Одну группу составили производные с особыми характеристиками. Для того чтобы иметь лишь одну полярную группу, одна из двух полярных групп должна быть блокирована. Для тиогликолевой кислоты, которую мы изучали, можно блокировать или тиоловую. или карбоксильную группу, оставляя некомбинированный радикал в качестве активной полярной группы. Поскольку мы были заинтересованы в веществах, имеющих тиоловую группу в качестве активного полярного радикала, карбоксильную группу блокировали путем замещения ее водорода метиловой группой. Метилтиогликолат был тщательно изучен в нашей лаборатории. Его фармакологическая активность подобна таковой других тиоловых препаратов, рассмотренных выше.
Другие тиогликолатные эфиры с этилом, пропилом или бутилом, взамен метила, были приготовлены и изучены, но не показали преимуществ над метиловым эфиром. Мы попытались получить аллильный эфир для того, чтобы иметь более мощный вторичный центр, но не смогли его синтезировать.
В этой же группе агентов мы изучили другое вещество, бетамеркаптопропаноловую кислоту, имеющую тиол и карбоксил в качестве полярных групп. При использовании в некомбинированном виде, можно наблюдать, что здесь, как и с тиогликолической кислотой, карбоксил действует в качестве активной полярной группы, в то время как тиол действует в качестве вторичного энергетического центра в неполярной группе. Указанная кислота очень токсична для животных, оказывая характерное воздействие - выраженный мышечный спазм. Соединение также вызывает необычную мышечную ригидность, наблюдаемую сразу после смерти. В нетоксической дозировке он оказывает заметное воздействие на рост опухоли. Многие опухоли исчезали, многие другие уменьшались в размерах. Впечатляющие результаты были получены при спонтанном раке грудной железы у мышей - высокий процент исчезновения опухолей (28/ 40). Повторные инъекции у этих животных давали хорошие результаты, если рост был настолько медленным, что позволял проводить лечение, по крайней мере, в течение месяца. Препарат, тем не менее, демонстрировал токсические эффекты у животных с опухолями, приводящие к потере веса, как это наблюдали при использовании тиогликолевого ряда. Для того, чтобы заменить полярную группу и заставить тиол действовать как таковой, мы блокировали карбоксил метилом в некоторых экспериментах и аллильной группой у других.Однакоиз-за указанных изменений влияние на опухоли у животных было уменьшено.
Связь с метаболизмом серы
Изучение липоидов с серой ставит проблему связи между их структурой и биологической активностью. Мы констатируем здесь это, потому что таким образом объясняется влияние, оказываемое этими агентами, но также из-за того, что тут содержится указание на должный способ развития исследования. Мы видели, что, в соответствии с систематизацией элементов, сера представляет собой неметаллический анти A элемент, активный особенно на межклеточном уровне. Интересно его действие в качестве изолированного элемента в дополнение к метаболическим изменениям, которые он вызывает в организме, присутствуя в негативном липоиде.
Кажется, что организм обычно метаболизирует двухвалентную отрицательную серу путем ее окончательного изменения в шестивалентную форму. Ferguson и du Vigneaud изучили метаболизм метионина и цистеина, являющихся главными источниками серы в организме. (125, 126) Сведений об этом предмете, которыми мы располагаем, слишком мало, чтобы хватило больше чем на рабочую гипотезу. К тому же, другие соединения липидного характера - тиолсодержащие липиды - имеют более значимую биологическую активность.
Метаболизм указанных соединений варьирует среди разных индивидуумов, особенно тех, которые страдали от патологических состояний. Изучение экскреции сульфгидрилов с мочой, выражаемое в виде сульфгидрильного индекса, служило для нас руководством в изучении метаболизма серы. Высокая экскреция тиоловой группы кажется связанной не только с низкой окисляемостью, но и с измененной формой, как указывалось выше, поскольку с увеличением экскреции уровень тиола в крови уменьшается. Указанная форма расценивается в качестве выделительной. Это, кажется, подтверждается тем фактом. что назначение двухвалентной серы, даже в большом количестве, не всегда сопровождается ее элиминацией в форме тиолов с мочой. У некоторых субъектов впечатляюще большой процент назначенных тиолов оказывается в моче. Указанное явление справедливо и для относительно малых количеств тиолов или двухвалентной серы, как в тиосульфатах. У других субъектов, наоборот, даже при назначении больших количеств, увеличение элиминации минимально или не происходит совсем. Порок метаболизма серы, что проявляется ограничением способности к ее окислению в шестивалентную положительную форму, также означает увеличение вмешательства тиоловой группы, как таковой, в экономию организма. Вышеизложенное происходит вместе с ранее описанными симптомами и признаками, соответствующими увеличенному окислительному вмешательству жирных кислот. В этих процессах тиолы, возможно, принимают участие.
Мы пытались изучить способность организма полностью окислить тиоловую серу как ответ на назначение известного количества серы в двухвалентной отрицательной форме. Изменение сульфгидрильного индекса мочи будет служить в качестве теста толерантности для тиолового метаболизма.
После инъекций 80 мг тиосульфата натрия могут наблюдаться различия в способности разных организмов его метаболизировать в связи с имеющимися патологическими состояниями. Указанная концепция тиолового метаболизма может служить основой понимания измененной формы тиоловой серы, которая может быть вовлечена в патогенез патологических состояний. Вещества, содержащие тиоловую группу, такие как метионин, цистеин и, особенно, глютатион, присутствуют в организме в измеряемых количествах, однако это не та форма тиола, которая вмешивается в нарушенный метаболизм. У субъектов с низкой сульфгидрильной экскрецией мочи в крови содержится большое количество нормальной формы тиола. Когда вмешивается другая, измененная, форма, она выделяется с мочой. Организм элиминирует указанное "аномальное" cоединение с сульфгидрилами. Кажется весьма возможным, что указанное измененное тиоловое соединение представлено в форме липида, поскольку сульфгидрил-содержащее соединение хорошо подвергается экстракции эфиром из мочи. Его аффинность к системе липидов помогает объяснить влияние, оказываемое на жирные кислоты и окислительные процессы, происходящие в системе липидов. Тиолипоиды вмешиваются каталитически в окисление жирных кислот, что видно в экспериментах in vitro.
Таким образом, тиоловая группа в липоидах, содержащих двухвалентную серу, скорее увеличит катаболический метаболизм, чем метаболизированный сульфат. Хотя тиол в указанной измененной форме элиминируется главным образом мочой, очевидно в качестве защитного механизма против его патологической активности, некоторая его часть, возможно, задерживается на клеточных липидах, где он сохраняет свою активность. Циркуляция серы в тиоловой липидной форме с последующим нарушением ее изменения из двухвалентной отрицательной серы в шестивалентную положительную серу, представляет основной источник серы, участвующей в измененной модели. Влияние, оказываемое назначенными тиосульфатами на сульфгидрильный индекс, может служить указателем этих специфических изменений.
Сера является анти-A элементом. Он активен как таковой во всех формах, в которых он существует в организме, хотя интенсивность ее действия варьирует на разных иерархических уровнях. Активность тиола в качестве анти-A фактора может быт связана с влиянием, оказываемым канцерогенами или другими агентами на биологическую активность этого радикала, особенно когда он участвует в формировании энзимов. Указанная связь объясняет результаты, полученные при повторных инъекциях клеток органов или опухолей, леченных in vitro агентами, имеющими тиол в качестве полярной группы. Вызванная этим гетерогенизция приводит к появлению тяжелых изменений вследствие аллергической реакции.
Интересно отметить, что сера имеет анти-A тенденцию даже в шестивалентной положительной форме, в которой она появляется в виде сульфата. Ион сульфата имеет способность в организме инактивировать липоиды положительного характера. Сульфат становится связанным с подобными веществами, таким образом, способствуя облегчению их экскреции с мочой. Многие из указанных веществ элиминируются в сочетании с серным радикалом в формах, называемых "сульфо-конъюгированными".
В виду выше отмеченного, эффект ионов сульфата оказывается подобным таковому жирных кислот. Как те, так и другие вещества, обладая положительным полярным характером, обладают также общим антагонизмом по отношению к антижирным кислотам. В том смысле, что они противостоят антижирным кислотам, как двухвалентная отрицательная, так и шестивалентная положительная, сера обладают анти-A aктивностью, первые - непосредственной, вторые - косвенной.
Специфическое влияние, оказываемое серой в ее разных формах, основывается на ее действии в качестве агента, вызывающего изменения в сторону увеличения гомотропии, действуя на уровнях выше клеточного. Это типичный пример связи между активностью элемента и его местом в периодической таблице. Сера является членом ряда, обладающего гомотропическим действием, она относится к периоду, соответствующему межклеточному компартменту и действующему, поэтому, выше клеточного уровня.
Липоиды селена
Влияние, оказываемое двухвалентной серой на процессы окисления, при которых участвуют жирные кислоты, служило поводом для проведения дальнейшего исследования. Занимаясь поиском агентов, которые будут действовать на все еще низшем уровне организации, даже ниже клеточного, мы рассматривали другие вещества, также воздействующие на окислительные процессы. Теоретически, по крайней мере, оказалось возможным вызвать изменения в компартменте ниже межклеточного, на котором действуют сульфгидрил-содержащие соединения.
Ранее мы обсуждали систематизацию биологической активности элементов, их фундаментальные анти-A и анти-D влияния, их распределение среди разных уровней организма, каждый из которых имеет свою атомную структуру и место в периодической таблице.
Все выше изложенное побудило нас исследовать селен, который является неметаллом, следующим за серой в шестом ряду периодической таблицы Менделеева в ряду с анти-A характером, в котором под первым номером стоит кислород. В соответствии с его периодом, селен относится к клеточному компартменту.
Первая проблема состояла в природе того соединения, в котором он будет активен. Мы особенно интересовались использованием двухвалентного отрицательного селена из-за активности двухвалентной отрицательной серы. Тем не менее, мы приступили к исследованию селеновых селенистых кислот. Указанные кислоты их натриевых солей оказывают ограниченное воздействие на вирусы и микробы. Интересный эффект оказывается на
Tetrahymena pyriformis, в которых индуцируется выраженная вакуолизация клеток. Влияние на опухоли, боль, органный и системный уровни менее выражено, токсические эффекты велики. Поэтому мы подготовили липоидические соединения с превалирующей неполярной группой и отрицательным двухвалентным селеном. Мы шире использовали гексил и гептил диселениды, синтезированные в наших л
Дата добавления: 2021-02-19; просмотров: 607;











