Зависимость скорости реакции от состава смеси
Смесь, в которой концентрации компонентов пропорциональны стехиометрическим коэффициентам в реакции между этими компонентами, называется стехиометрической. Максимальная скорость реакции наблюдается в стехиометрической смеси.
При избытке горючего или окислителя скорость реакции уменьшается ввиду уменьшения тепловыделения. При наличии инертной примеси скорость реакции уменьшается в результате уменьшения концентрации реагирующих веществ. Это наблюдается при использовании воздуха в качестве окислителя, который наряду с кислородом содержит и азот, являющийся инертной примесью.
Рассмотрим реакцию горения метана в среде чистого кислорода, когда сумма объемных долей метана и кислорода равна единице: 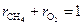 . В соответствии с законом действующих масс скорость реакции определяется выражением
. В соответствии с законом действующих масс скорость реакции определяется выражением
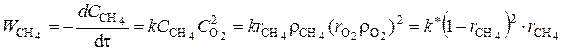 , (3.5)
, (3.5)
где 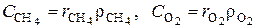 - концентрации метана и кислорода в исходной смеси; k – константа скорости химического реагирования,
- концентрации метана и кислорода в исходной смеси; k – константа скорости химического реагирования, 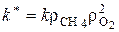 - комплекс, не зависящий от объёмных долей компонентов в смеси. При концентрациях метана и кислорода в исходной смеси, равных нулю, скорость химического реагирования естественно будет равной нулю:
- комплекс, не зависящий от объёмных долей компонентов в смеси. При концентрациях метана и кислорода в исходной смеси, равных нулю, скорость химического реагирования естественно будет равной нулю: 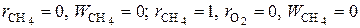 . Для определения максимума скорости реагирования продифференцируем выражение (3.5) по объёмной доле метана в исходной смеси и приравняем производную нулю:
. Для определения максимума скорости реагирования продифференцируем выражение (3.5) по объёмной доле метана в исходной смеси и приравняем производную нулю:
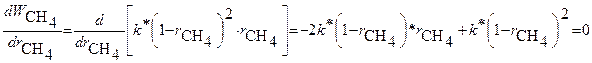 . (3.6)
. (3.6)
Отсюда 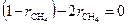 . Тогда объёмная доля метана, при которой скорость реагирования метана с кислородом будет максимальна, составит
. Тогда объёмная доля метана, при которой скорость реагирования метана с кислородом будет максимальна, составит 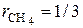 , что соответствует объёмной доле метана в стехиометрической смеси (рис. 3.3).
, что соответствует объёмной доле метана в стехиометрической смеси (рис. 3.3).
3.2. Цепные реакции
Эксперимент показывает, что в большинстве случаев кинетическое уравнение реакции не может быть составлено на основании стехиометрического уравнения по числу исходных молекул, участвующих в реакции. В действительности реакции протекают не между молекулами исходных веществ, а через промежуточные стадии, в которых образуются промежуточные активные продукты. Реакции совершаются между активными промежуточными продуктами и исходными веществами, причем наряду с конечными продуктами вновь образуются активные промежуточные продукты, которые обеспечивают дальнейшее протекание реакции. Подобные реакции называются цепными.
| Рис. 3.3. Зависимость относительной скорости химического реагирования метана с кислородом от объемной доли метана в смеси |
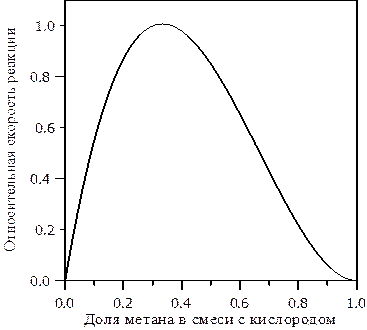
Различают неразветвленные цепные реакции, когда при реагировании концентрации активных продуктов остаются постоянными, и разветвленные цепные реакции, когда с течением времени увеличивается концентрация активных продуктов. Примером неразветвленной цепной реакции является реакция окисления азота.
Реакция зарождения цепей: O2 + ν = 2O. Здесь ν -это необходимая энергия для разрушения связей. Далее следуют реакции с образованием промежуточных веществ и конечных продуктов:
O + N2 = NO + N
N + O2 = NO + O
O + O2 + N2=O+2NO
Итоговая реакция показывает, что при протекании реакции количество активных промежуточных веществ (в данном случае атома кислорода) не изменяется.
Дата добавления: 2016-11-26; просмотров: 2105;











