Ковалентная связь. Понятие о полярной ковалентной и ионной связи.
В слове "ковалентная" приставка "ко-" означает "совместное участие". А "валента" в переводе на русский - сила, способность. В данном случае имеется в виду способность атомов связываться с другими атомами.
При образовании ковалентной связи атомы объединяют свои электроны как бы в общую "копилку" - молекулярную орбиталь, которая формируется из атомных оболочек отдельных атомов. Эта новая оболочка содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки.
Рассмотрим возникновение ковалентной связи на примере образования молекулы водорода из двух атомов водорода (рис. 3-1). Этот процесс уже является типичной химической реакцией,потому что из одного вещества (атомарного водорода) образуется другое - молекулярный водород. Внешним признаком энергетической выгодности этого процесса является выделение большого количества теплоты.
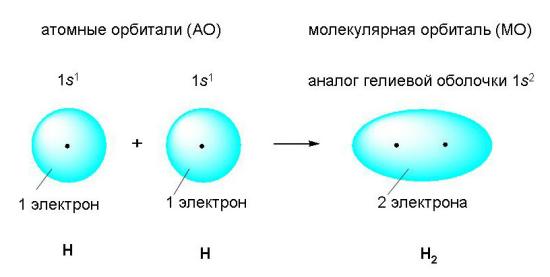
Рис 3-1. Возникновение ковалентной связи при образовании молекулы водорода из двух атомов водорода. Электронные оболочки атомов водорода (с одним s-электроном у каждого атома) сливаются в общее электронное облако (молекулярную орбиталь), где оба электрона "обслуживают" ядра независимо от того, "свое" это ядро или "чужое".
Когда электронные оболочки двух атомов водорода сближаются и образуют новую, теперь уже молекулярную электронную оболочку (рис. 3-1), эта новая оболочка подобна завершенной электронной оболочке атома благородного газа гелия (1s2).
Завершенные оболочки, как мы помним, устойчивее незавершенных. Таким образом, суммарная энергия новой системы - молекулы водорода - оказывается гораздо ниже суммарной энергии двух несвязанных атомов водорода. Избыток энергии при этом выделяется в виде теплоты.
Минимум энергии молекулы отвечает определенному расстоянию между ядрами атомов водорода (рис. 3-2). Если атомы в молекуле с помощью внешней силы сдвинуть еще ближе, то в действие вступает мощное отталкивание между одноименно заряженными ядрами атомов и общая энергия системы начинает быстро возрастать. Это невыгодно системе, поэтому длина связи представляет собой строго определенное, равновесное значение. Для молекулы водорода равновесная длина химической связи составляет 0,74 ангстрема (1 А = 10-8см), как это видно на рис. 3-2.
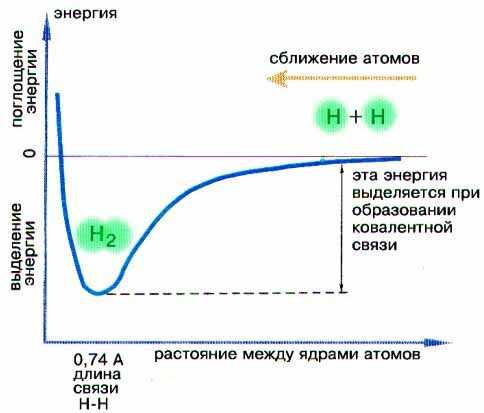
Рис. 3-2. Кривая изменения потенциальной энергии при взаимодействии двух атомов водорода с образованием молекулы водорода.
В образовавшейся системе из двух водородных атомов каждое ядро обслуживается двумя электронами. В новой (молекулярной) оболочке уже невозможно различить, какой из электронов ранее принадлежал тому или другому атому. Принято говорить, что электроны обобществлены.
Поскольку оба ядра претендуют на пару электронов в равной степени, электронная плотность сосредоточена как вокруг ядер, так и в пространстве между атомами (это показано на рис. 3-3). Именно эту область повышенной электронной плотности между ядрами и называютковалентной связью.
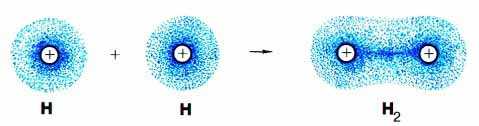
Рис. 3-3. Другой способ изображения атомных и молекулярной орбиталей: густота точек отражает "электронную плотность", то есть вероятность нахождения электрона в какой-либо точке пространства около ядер атомов водорода. Видно, что значительная электронная плотность сосредоточена в пространстве между двумя ядрами в молекуле водорода.
На рисунках 3-1 и 3-3 вы видите очень детальное изображение ковалентной связи. На практике используют более простые способы. Например, американский химик Дж. Льюис в 1916 году предложил обозначать электроны точками рядом с символами элементов. Одна точка обозначает один электрон. В этом случае образование молекулы водорода из атомов записывается так:
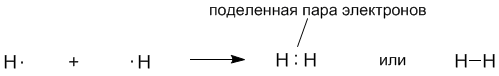
Оказалось, что формулы Льюиса имеют глубокий химический смысл. Мы видим, что связь между атомами водорода обозначается парой электронов. Как предположил Льюис, именно пара электронов позволяет образовать ковалентную связь. Впоследствии это предположение подтвердилось квантовой теорией.
Дата добавления: 2016-11-04; просмотров: 2120;











