Электронная конфигурация. Электронные формулы. Орбитальные диаграммы. Правило октета.
Наша задача - разобраться в том, как заполняются электронные уровни, подуровни и орбитали по мере усложнения атома.
Существует условное изображение электронных уровней и подуровней, называемое орбитальной диаграммой. На такой диаграмме орбитали условно изображаются квадратиками, а электроны - стрелочками. Если стрелочки направлены в разные стороны, это означает, что электроны различаются между собой особым свойством, которое назывется спином электрона. В данный момент для нас не важна суть этого свойства. Требуется лишь понимать, что электроны могут чем-то отличаться друг от друга.
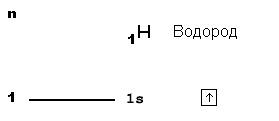
На схеме вверху вы видите орбитальную диаграмму атома водорода, у которого единственный электрон размещается на самом близком к ядру 1-м уровне. На этом уровне только одна s-орбиталь (на схеме она показана квадратиком). Собственно, квадратик с изображением внутри электрона-стрелочки и является орбитальной диаграммой.
Теперь рассмотрим атом гелия:
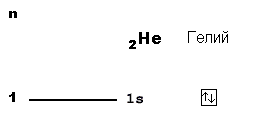
В атоме гелия (2 протона в ядре) уже два электрона, причем оба еще могут поместиться на 1-м уровне. Значит, "адрес" этих электронов такой же, как у водорода: 1s. Но чтобы показать, что здесь находится уже не 1, а 2 электрона, пишут “адрес” с указанием количества “жильцов”-электронов: 1s2. Эта короткая запись описывает электронное строение атома гелия. Поэтому такие записи называют электронными формулами. 1s1 - электронная формула атома водорода. 1s2 - электронная формула атома гелия.
Рассмотрим атом лития:
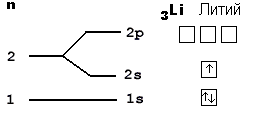
У него три протона в ядре, поэтому литий содержит в своем электронном облаке 3 электрона, для чего занимает электронами сначала весь 1-й уровень (там помещается только 2 электрона), а оставшийся электрон вынужден переместиться на более высокий 2-й уровень, где займет ближайшую к ядру свободную 2s-орбиталь. "Адрес" трех электронов этого элемента таков: 1s2 2s1. Мы записали электронную формулу для лития.
Из этих простых примеров становится ясен принцип минимума энергии при заполнения электронных оболочек: в первую очередь заполняются более низкие, ближайшие к ядру уровни и подуровни.
На рис. 2-8 показана более подробная орбитальная диаграмма для первых электронных уровней большинства атомов.
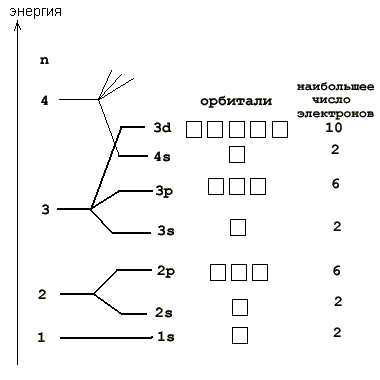
Рис. 2-8. Порядок заполнения орбиталей на первых, наиболее близких к ядру электронных уровнях у большинства атомов. Заполнение электронами происходит снизу вверх. Справа показано наибольшее количество электронов, способных разместиться на орбиталях данного подуровня. 4-й уровень показан не полностью.
Чем дальше от ядра располагаются уровни и подуровни, тем выше их энергия. По некоторым (до сих пор не вполне понятным) причинам 4s-подуровень многих атомов (за исключением атомов самых "легких" элементов) заполняется электронами раньше, чем 3d-подуровень. Такие аномалии встречаются и на более высоких уровнях. Вот как выглядит порядок заполнения уровней и подуровней в атомах большинства элементов:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, ...
Нет никакой необходимости запоминать эту последовательность. В главе 4 мы научимся легко извлекать ее из Периодической таблицы Д.И.Менделеева.
** Если говорить более строго, то относительное расположение подуровней обусловлено не столько их большей или меньшей энергией, сколько требованием минимума полной энергии атома. Исходя из этого требования, минимум энергии достигается у большинства атомов тогда, когда их подуровни заполняются в показанной выше последовательности. Но есть и исключения, которые вы можете найти в таблицах "Электронные конфигурации элементов" (см. меню слева). Однако эти исключения редко приходится принимать во внимание при рассмотрении химических свойств элементов.
Пользуясь рис. 2-8, мы можем приступить к заполнению электронных уровней атомов многих элементов. Как нам уже известно, атом каждого элемента содержит строго определенное число электронов, равное числу протонов в его ядре (то есть заряду ядра). Правила заполнения электронных оболочек следующие:
1. Сначала выясняем, сколько всего электронов содержит атом интересующего нас элемента. Для этого достаточно знать заряд его ядра, который, как мы увидим в главе 4, всегда равен порядковому номеру элемента в Периодической таблице Д.И.Менделеева. Порядковый номер (число протонов в ядре) в точности равен и числу электронов во всем атоме.
2. Последовательно заполняем орбитали, начиная с нижней 1s-орбитали, имеющимися электронами (рис. 2-8). При этом нельзя располагать на каждой орбитали более двух электронов.
3. Записываем электронную формулу элемента.
Электронная формула описывает распределение электронов по энергетическим уровням, существующим в электронном облаке. Такое распределение называется также электронной конфигурацией атома.
Запись электронной формулы проще показать на конкретном примере. Допустим, нам надо выяснить электронную формулу элемента с порядковым номером 7. В атоме такого элемента должно быть 7 электронов. Заполним орбитали семью электронами, начиная с нижней 1s-орбитали.
Итак, 2 электрона расположатся на 1s-орбитали, еще 2 электрона - на 2s-орбитали, а оставшиеся 3 электрона смогут разместиться на трех 2p-орбиталях.
Электронная формула элемента с порядковым номером 7 (это элемент азот, имеющий символ “N”) выглядит так:
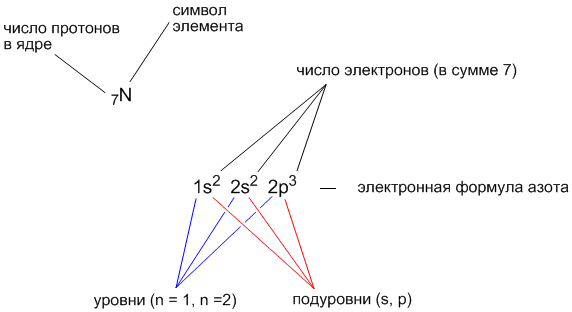
Существует правило (оно называется правилом Гунда), по которому электроны предпочитают расселяться на одинаковых по энергии орбиталях (например, на трех p-орбиталях) сначала по одиночке, и лишь когда в каждой такой орбитали уже находится по одному электрону, начинается заполнение этих орбиталей вторыми электронами. Когда орбиталь заселяется двумя электронами, такие электроны называютспаренными.
Посмотрим действие правила Гунда на примере элемента азота (1s2 2s2 2p3). На 2-м электронном уровне есть три одинаковых p-орбитали: 2px, 2py, 2pz. Электроны заселят их так, что на каждой из этих p-орбиталей окажется по одному электрону. Объясняют это тем, что в соседних ячейках электроны меньше отталкиваются друг от друга, как одноименно заряженные частицы.
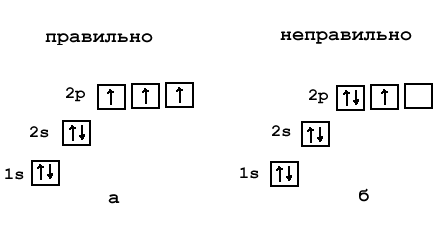
Рис. 2-9. Правильная (а) и неправильная (б) орбитальная диаграмма азота. В соответствии с правилом Гунда орбитали заселяются сначала одиночными, а не спаренными электронами.
По правилу Гунда при заполнении электронами одинаковых по энергии орбиталей электроны располагаются в первую очередь по одиночке на каждой орбитали, и лишь потом начинается заселение этих орбиталей вторыми электронами.
Полученная нами электронная формула азота несет очень важную информацию: 2-й (внешний) электронный уровень азота заполнен электронами не до конца (на нем 2 + 3 = 5 электронов) и до полного заполнения не хватает трех электронов.
Внешним уровнем атома называется самый далекий от ядра уровень, на котором еще есть электроны. Именно эта оболочка соприкасается при столкновении с внешними уровнями других атомов в химических реакциях. При взаимодействии с другими атомами азот способен принять 3 дополнительных электрона на свой внешний уровень. При этом атом азота получит завершенный, то есть максимально заполненный внешний электронный уровень, на котором расположатся 8 электронов.
Завершенныйуровень энергетически выгоднее незавершенного (о том, как это выяснилось, вы узнаете уже в этом параграфе). Поэтому атом азота должен легко реагировать с любым другим атомом, способным предоставить ему 3 дополнительных электрона для завершения его внешнего уровня.
Другой пример: элемент с порядковым номером 18. Действуя так же, как и в первом случае, мы с помощью рис. 2-8 расположим 18 электронов в следующую электронную формулу:
1s2 2s2 2p6 3s2 3p6
Элемент с порядковым номером 18 - это аргон (знакомый нам по предыдущей главе). Он уже имеет полностью завершенный внешний уровень и, следовательно, не склонен реагировать с другими элементами. Действительно, химическое поведение аргона настолько выделяется своей пассивностью среди других элементов, что он получил название инертного газа или благородного газа (последнее, вероятно, за свою "химическую лень"). Аргон (в переводе с греческого "недеятельный") не реагирует ни с одним химическим элементом. В свободном состоянии он существует не в виде двухатомных молекул (как другие газы), а в виде отдельных атомов (вот мы и ответили на один из вопросов параграфа 2.1 этой главы!)
Инертность аргона такова, что до сих пор, несмотря на все попытки, не удалось получить ни одного его устойчивого соединения.
** Аргон является не единственным благородным или инертным газом. Существуют также элементы гелий (He, заряд ядра 2), что означает "солнечный" (впервые обнаружен на Солнце спектральными методами и только потом - в минерале клевеите); неон (Ne, "новый", заряд ядра 10); криптон (Kr, "скрытный", заряд ядра 36); ксенон (Xe, "странный", заряд ядра 54). Существует также радиоактивный благородный газ радон (Rn, заряд ядра 86), медленно выделяющийся из горных пород. Все эти газы в небольших количествах имеются в атмосфере.
Из-за своей химической инертности благородные газы долго не были известны химикам. Аргон был открыт первым благодаря наблюдательности английского ученого Джона Уильяма.Рэлея.
В 1892 году Рэлей столкнулся с загадочным фактом, который было трудно объяснить: газ азот, полученный из атмосферы, оказывался неизменно "тяжелее" азота, полученного путем его выделения из химических соединений. Если 1 л азота, полученного из воздуха, весил 1,2572 г, то 1 л азота, полученного разложением азотистых соединений, весил 1,2505 г !
 Менее аккуратный исследователь либо не заметил бы такую маленькую разницу, либо отнес ее за счет погрешности измерений. Но Рэлей многократно повторил свои опыты и выяснил, что это не случайность. Вместе с другим британским ученым - Уильямом Рамзаем - он пришел к выводу, что в атмосферном азоте, очищенном от других известных газов, может скрываться какой-то новый, неизвестный ранее “тяжелый” газ.
Менее аккуратный исследователь либо не заметил бы такую маленькую разницу, либо отнес ее за счет погрешности измерений. Но Рэлей многократно повторил свои опыты и выяснил, что это не случайность. Вместе с другим британским ученым - Уильямом Рамзаем - он пришел к выводу, что в атмосферном азоте, очищенном от других известных газов, может скрываться какой-то новый, неизвестный ранее “тяжелый” газ.
Спустя два года они осуществили эксперимент по поглощению азота раскаленным магнием при пропускании искрового электрического разряда и выделили оставшийся в сосуде таинственный газ, который оказался в 20 раз тяжелее водорода. Это и был аргон.
Впоследствии У. Рамзай провел эксперименты по дробной перегонке жидкого воздуха и открыл еще три инертных газа: неон, ксенон и криптон. Гелий также впервые был выделен Рамзаем в опыте по обработке минерала клевеита горячей серной кислотой.
Многочисленные попытки химиков заставить благородные элементы вступать в химические реакции увенчались успехом лишь сравнительно недавно: начиная с 60-х годов известно несколько десятков соединений ксенона и криптона с наиболее "агрессивным" из всех химических элементов - фтором, а также с кислородом. Однако до сих пор неизвестно ни одного стабильного соединения гелия, неона и аргона. В 2000 г. появилось сообщение о получении гидрофторида аргона HArF, однако «подержать в руках» это соединение не удается: уже при очень низких температурах оно распадается. Зато вы можете подержать в руках сам аргон - им заполняют электрические лампочки накаливания (только не надо ломать лампочку - можно пораниться!). Аргон не реагирует с раскаленным металлическим волоском лампочки и хорошо отводит от него тепло.
Мы получили электронную формулу аргона. Рассмотрим электронные формулы двух других благородных элементов с зарядом ядра 10 и 36 - неона и криптона. В их атомах содержится соответственно 10 и 36 электронов. Используя рис. 2-8 и правила заполнения электронных уровней получим:
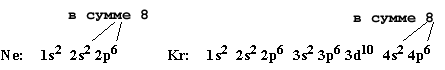
Итак, электронные формулы этих благородных газов показывают, что неон имеет заполненный 2-й внешний уровень ( n = 2), а криптон - заполненный 4-й внешний уровень (n = 4). На каждом таком полностью заполненном уровне находится по 8 электронов.
** Внимательный читатель может возразить, что внешняя оболочка криптона, строго говоря, не является заполненной, поскольку свободны 4d-орбитали. Действительно, правильнее говорить о завершенных 4s и 4p-подуровнях криптона.
Чтобы полностью заполнить 4-й уровень, следующие за криптоном элементы вынуждены перед 4d-орбиталями заполнить сначала более "низкий" (по энергии) 5s-подуровень. В результате элемент, даже имеющий полный набор 4d-электронов, должен обязательно иметь 5s-электроны. Такой элемент имеет незавершенный 5-й уровень и может не быть благородным газом.
Причины необычайной устойчивости атомов с полностью заполненными s- и p-подуровнями до сих пор не совсем ясны. Нам полезно воспринять этот очень важный факт как известный химикам из природы, из опыта. В дальнейшем завершенность или незавершенность внешних уровней атомов позволит нам оценить многие химические свойства элементов.
 Отметим, что каждый заполненный внешний электронный уровень благородных элементов содержит (s2 + p6) то есть 8 электронов. Логично предположить, что именно заполненные внешние электронные уровни являются причиной химической инертности благородных элементов, поскольку все другие элементы имеют частично незаполненные внешние электронные уровни.
Отметим, что каждый заполненный внешний электронный уровень благородных элементов содержит (s2 + p6) то есть 8 электронов. Логично предположить, что именно заполненные внешние электронные уровни являются причиной химической инертности благородных элементов, поскольку все другие элементы имеют частично незаполненные внешние электронные уровни.
Но тогда логично выглядит и другое предположение: химические свойства "не благородных" элементов связаны с их стремлением завершить свои внешние электронные оболочки. Это предположение подтверждается многочисленными фактами и получило название правила октета (восьмерка - октет).
Образно говоря, атомы элементов "любят" наряжаться в электронные одежды благородных газов. Они стремятся создавать завершенные внешние электронные уровни (оболочки) из 8 электронов, отдавая свои электроны другим атомам или, наоборот, принимая электроны других атомов. Такой обмен электронами и вызывает все многообразие химических реакций.
Более строгая формулировка правила октета может выглядеть так:
Атомы элементов стремятся к наиболее устойчивой электронной конфигурации. Устойчивой является электронная конфигурация с завершенным внешним электронным уровнем из (s2 + p6), т.е. из октета электронов.
Только в одном случае завершенная оболочка может включать не 8, а 2 электрона. Благородный газ гелий (порядковый номер 2) имеет завершенную внешнюю оболочку из 2-х электронов (1s2). Причина этого исключения вполне понятна: на самом нижнем уровне помещается только одна s-орбиталь, на которой можно разместить не более двух электронов. Физический смыслправила октета при этом не меняется. Суть его в том, что только завершенная электронная оболочка наиболее выгодна для атома, поскольку в этом случае электронная конфигурация обладает наименьшей энергией. Впрочем, иногда правило октета называют и "правилом октета-дублета".
С правилом октета тесно связаны донорные и акцепторные свойства атомов. Атомы - доноры электронов - склонны достигать октета, отдавая "лишние" электроны со своих внешних электронных уровней. Это атомы, у которых внешние электронные уровни только начинают застраиваться. Наоборот, атомы-акцепторы электронов легче достраивают свои внешние уровни до октета, принимая на них электроны других атомов. Обычно это элементы с уже почти завершенными внешними электронными уровнями. Как мы уже знаем, принимая или отдавая электроны, атомы могут превращаться в ионы. Например:
11Na (металл натрий: 1s2 2s2 2p6 3s1)-e- = 11Na+ (ион натрия: 1s2 2s22p6 - октет)
9F(газ фтор: 1s2 2s2 2p5) + e- = 9F- (ион фтора: 1s2 2s22p6 - октет)
Для атомов со сходными электронными оболочками донорные и акцепторные свойства - при прочих равных условиях - зависят еще и от удаленности внешнего уровня от ядра. У маленьких атомов с небольшим числом уровней внешний уровень подвергается заметному влиянию ядра (электроны удерживаются крепче), а у больших (тяжелых) элементов внешние уровни как бы отделены от ядра "экраном" из нижних электронных уровней, поэтому электроны внешнего уровня удерживаются слабее. При прочих равных условиях - то есть при одинаковом строении внешних уровней, более акцепторные свойства проявляют более "легкие" элементы.
Например, два близких по свойствам газа - фтор (порядковый номер 9) и хлор (порядковый номер 17) - имеют одинаковое строение внешних электронных уровней:
Фтор (F): 1s2 2s22p5 ;
Хлор (Cl): 1s2 2s2 2p6 3s23p5
Акцепторные свойства фтора выше, потому что его внешний электронный уровень находится ближе к ядру, чем у хлора. Это означает, что фтор (по сравнению с хлором) в химических реакциях ведет себя более "агрессивно" и легче заполняет свой внешний уровень до октета, забирая недостающий электрон у какого-либо другого элемента. Подтверждение этому факту мы уже знаем: существуют соединения фтора даже с благородными элементами ксеноном и криптоном, но до сих пор не известно соединений благородных газов с хлором.
Донорные и акцепторные свойства относительны. Донорные свойства элементов проявляются обычно в присутствии акцепторов, а акцепторные - в присутствии доноров.
Задачи к главе 2 (кроме § 2.7)
2.8. Напишите электронные формулы для следующих элементов: 6C, 12Mg, 16S, 21Sc.
2.9. Элементы имеют следующие электронные формулы:
а) 1s2 2s2 2p4.
б) 1s2 2s2 2p6 3s2 3p1.
в) 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
Какие это элементы? Напишите их латинские символы и названия на латинском и русском языках.
2.10. Элемент имеет внешний электронный уровень такого строения: ...3p3. Что это за элемент?
2.11. Заполните пропуски в таблице:
| Символ | 168O | 21D+ | |||
| Число протонов | |||||
| Число нейтронов | |||||
| Число электронов | |||||
| Суммарный заряд | +1 | +3 |
2.12. Заполните пропуски в таблице:
| Символ | 147N | 3517Cl- | |||
| Число протонов | |||||
| Число нейтронов | |||||
| Число электронов | |||||
| Суммарный заряд | -1 | +2 |
2.13. Напишите электронную формулу для элемента с зарядом ядра Z = 12.
2.14. Какие из перечисленных атомов и ионов имеют электронные конфигурации, одинаковые с атомом 18Ar:
Ca2+, Cl-, K, Na+, S2-, As3-, Al3+ ?
2.15. Какие из перечисленных подуровней не существуют:
2s, 4f, 2p, 3d, 1p, 2d, 1s, 3f ?
2.16. Сколько электронов и протонов содержит молекула аммиака NH3 ?
2.17. Даны элементы с зарядами ядер Z = 3 и Z = 19. Который из них лучший донор электронов?
2.18. Перечисленные элементы разделите на доноры и акцепторы электронов. Сколько электронов нужно отдать или принять каждому из них, чтобы приобрести электронную оболочку благородного газа неона? Напишите символы соответствующих ионов этих элементов: O, Na, Al, Mg, F.
2.19. Атом превращается в ион, если принимает или отдает электроны с внешней оболочки. Напишите электронные формулы элементов с зарядами ядер Z = 3 и Z = 9. Руководствуясь правилом октета, ответьте на вопрос: какой из этих элементов склонен образовывать отрицательно заряженные, а какой - положительно заряженные ионы?
2.20. Даны элементы с зарядами ядер Z = 7 и Z = 15. Который из них лучший акцептор электронов?
** 2.21. Напишите электронную формулу элемента с зарядом ядра Z = 24. Нарисуйте орбитальную диаграмму последней (внешней) электронной оболочки.
** 2.22. Даны два элемента - с зарядами ядер Z = 17 и Z = 18. Один из них - ядовитый газ с резким запахом. Другой не ядовит, лишен запаха, не поддерживает дыхания. Напишите электронные формулы обоих элементов. Какой из них ядовит?
** 2.23. Нарисуйте орбитальную диаграмму для углерода (заряд ядра Z = 6). Сколько неспаренных электронов на внешней электронной оболочке углерода?
** 2.24. На основании строения атома выберите из двух частиц более сильный акцептор электронов: а) атом F, б) ион Na2+.
** 2.25. Представьте, что у вас имеются точнейшие весы, на которых можно взвешивать атомы элементов. Укажите, какая из частиц в каждой паре будет тяжелее:
а) F и F-
б) Na и Na+
в) F- и Ne
г) Na+ и Ne.
** § 2.7 Понятие о квантовой теории строения атома. Атомные спектры. Квантовые числа.
Одним из инструментов, который помог "заглянуть" внутрь невидимых, микроскопических атомов, послужила квантовая теория. В предыдущих разделах вы уже познакомились со многими понятиями, которыми эта теория оперирует (ядро, электронное облако, уровни, подуровни, орбитали, электронная конфигурация, минимум энергии и т.д.). Полезно еще раз вернуться к вопросу о том, как появились эти понятия, какие экспериментальные факты заставили исследователей нарисовать именно такую, а не иную картину строения атома.
Для начала нам придется разобраться в свойствах волн. Обычные волны (например, волны на воде) и электромагнитные волны (например, солнечный свет), имеют некоторые похожие свойства.
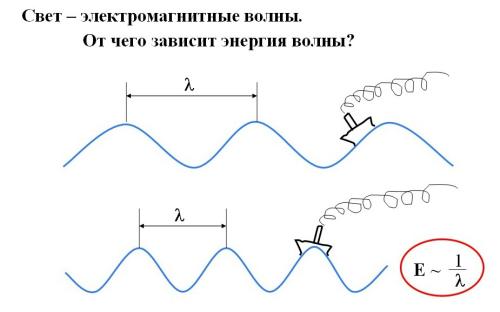
Представим плывущее по океанским волнам тяжелое грузовое судно. В настоящем океане по водной поверхности движется одновременно много волн. Мы с вами рассмотрим упрощенный случай: пусть по морю бежит одна-единственная волна с одинаковыми расстояниями между гребнями. Например, такая, как в верхней части рис. 2-10.
 <="" p="">
<="" p="">
Рис. 2-10. Мысленный опыт с океанскими волнами, показывающий связь между длиной (l), частотой (n) и энергией (Е) волны. Чем меньше длина волны (l), тем больше частота подъемов на гребень (n) и энергия волны (E). Таким образом, энергия волны E = kn, где k – коэффициент пропорциональности.
Когда гребень волны прокатывается под кораблем, тяжелое судно поднимается вверх. Значит, волна способна совершать работу. Допустим, морская волна в верхней части рис. 2-10 достаточно пологая, а морская волна в нижней части рисунка - более частая, похожая на зыбь. При этом пусть высота волн в обоих случаях будет одинаковой, чтобы одинаковой была и высота подъема судна на волне. Тогда получится, что нижняя волна совершает больше работы: на ее гребнях корабль поднимается в единицу времени чаще.
Чем больше расстояние между гребнями волны, тем меньшее число раз поднимается корабль в единицу времени. Расстояние между гребнями волны называется длиной волны и обозначается греческой буквой l (лямбда). Частота волны - это число подъемов судна на гребень волны в единицу времени, обозначается буквой n (ню).
Итак, поднимая корабль вверх, волна совершает работу. Значит, чем меньше длина волны (или чем больше частота), тем большую энергию несет волна. Энергия волны Е пропорциональна ее частоте: Е = kn , где k - некая константа, которую можно определить экспериментально.
Свет, испускаемый нагретыми телами (например, Солнцем), также представляет собой волновые колебания электрической и магнитной энергии. Чем больше частота такой электромагнитной волны, тем большую энергию она несет. Волны света с разной энергией оказывают разное влияние на сетчатку глаза. Световые волны высокой частоты воспринимаются нами как фиолетовые. Если постепенно уменьшать частоту (увеличивать длину волны света), то цвет становится сначала синим, потом голубым, зеленым, желтым, оранжевым и, наконец, красным. Красный свет несет меньше всего энергии.
Солнечный свет выглядит белым потому, что в нем смешаны электромагнитные волны всех частот. Если с помощью стеклянной или кварцевой призмы разложить солнечный свет на составляющие его волны, то мы увидим красивую радугу, называемую солнечным спектром(рис. 2-11).
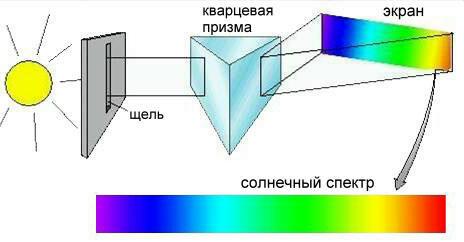
Рис. 2-11. Спектр солнечного излучения, полученный с помощью простейшего спектрометра.
Прибор, изображенный на рис. 2-11, называется спектрометром. Спектр электромагнитного излучения на самом деле гораздо шире, чем может увидеть человеческий глаз (рис. 2-12).
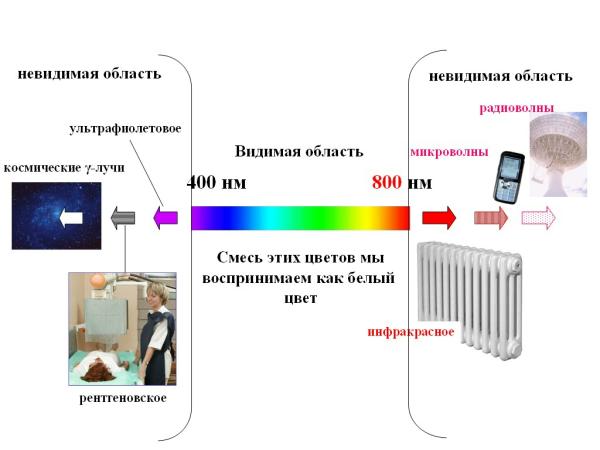
Рис. 2-12. Длины волн и названия некоторых видимых и невидимых областей солнечного спектра.
Левее видимой области находится невидимая глазу ультрафиолетовая область спектра. Еще левее находятся очень коротковолновые рентгеновские лучи и совсем коротковолновые космические лучи, которые несут так много энергии, что опасны для живых организмов. К красной области примыкает невидимая инфракрасная область спектра, затем следуют микроволновая и радиоволновая области. Эти волны несут меньше энергии, чем видимый и ультрафиолетовый свет.
Длины волн измеряются в метрах (радиоволны), сантиметрах (микроволны) и чаще всего в нанометрах (видимая и ультрафиолетовая области). Нанометр (нм) - миллиардная часть метра (1 нм = 10-9 м). Видимая человеку область спектра простирается примерно от 400 до 800 нм (рис. 2-12).
Нагретые тела испускают свет, потому что это позволяет им избавиться от избытка энергии. Привычный нам дневной свет испускается поверхностью Солнца, разогретой до 6000 оС.
Если кусок железа нагревать на сильном огне, он начинает светиться сначала темно-вишневым, а потом красным светом. Точно так же другие элементы в сильно разогретом состоянии могут испускать свет, который можно разложить на составляющие его волны с помощью спектрометра.
Такие спектры называются спектрами испускания. Спектр испускания водорода (рис. 2-13) оказался не сплошным, как у солнечного света, алинейчатым. Обнаруженное явление требовало объяснения, которое долгое время не могли найти.
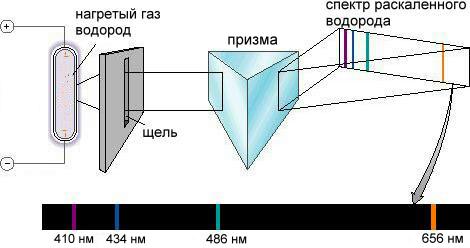
Рис. 2-13. Спектр испускания раскаленного атомарного водорода. Водород в так называемой водородной лампе разогревается сильным электрическим разрядом. Испускаемый атомами водорода свет, пройдя через призму, дает спектр, состоящий из отдельных линий. На рисунке показана только видимая область спектра. Позже, с совершенствованием спектрометров, были открыты серии линий в ультрафиолетовой и в инфракрасной области.
Еще до опытов Резерфорда, когда о строении атома было известно мало, физики упорно искали ответ на вопрос: каким образом нагретое вещество испускает свет? Предполагалось, что свет возникает в результате колебаний групп атомов и частота этих колебаний как-то связана с частотой волны испускаемого света. Но как устроен атом и почему его колебания приводят к излучению? Эти (и не только эти) вопросы заставляли исследователей предлагать различные гипотезы строения атома.
Уже были получены первые экспериментальные данные о заряженных частицах - электроне и протоне. Разумеется, в тот момент вряд ли кто-нибудь мог с уверенностью сказать, что эти частицы имеют отношение к строению атома, но открытие электрона и предположение о существовании протона уже позволяли выдвигать гипотезы о внутреннем устройстве атомов на основе этих "строительных деталей". Именно тогда появилась модель атома, которую предложил Дж. Дж. Томсон, а чуть позже - модель атома, предложенная Э.Резерфордом (рис. 2-3 а и б).
 Рис. 2-3 из §2.2. Модели атома: а) Томсона (“сливовый пудинг”), б) Резерфорда ("электронный рой" в пространстве вокруг ядра), в) планетарная модель Бора.
Рис. 2-3 из §2.2. Модели атома: а) Томсона (“сливовый пудинг”), б) Резерфорда ("электронный рой" в пространстве вокруг ядра), в) планетарная модель Бора.
Опыты Резерфорда, о которых подробно рассказано в параграфе 2.2, произвели сильное впечатление на физиков того времени. Но если модель Томсона отвергалась в пользу модели Резерфорда, то возникал неразрешимый вопрос: почему электроны не падают на ядро? Если допустить, что в электронном облаке их удерживает центробежная сила, возникающая при быстром вращении вокруг ядра, то тогда возникает другое затруднение: электрический заряд, движущийся в магнитном поле ядра, неизбежно должен излучать энергию. Если бы атом постоянно излучал энергию, он бы не мог существовать. Классическая физика оказалась бессильной перед этой проблемой.
К счастью, существовало еще одно досадное затруднение классической физики, разрешение которого неожиданно помогло продвинуться в понимании строения атома. Классическая физика не могла объяснить, почему при нагревании физическое тело начинает светиться не синим или фиолетовым, а красным светом. С помощью излучения нагретое физическое тело избавляется от излишка энергии. Но наиболее эффективная, быстрая отдача энергии должна происходить с помощью коротковолновых световых волн, способных нести много энергии! В этом случае нагреваемый в горне кусок железа должен выглядеть фиолетовым или синим, но не красным! Наше Солнце - огромное, нагретое до высоких температур физическое тело, должно заливать Землю фиолетовым (и даже еще более коротковолновым) излучением. Разумеется, это резко противоречит тому, что мы наблюдаем.
Берлинский профессор Макс Планк в течение многих лет занимался этой проблемой. В конце концов он пришел к выводу, что единственный выход - это предположить, что излучение света веществом происходит не непрерывно, а отдельными "элементарными" порциями энергии, которые рождаются колеблющимися атомами. Такие “порции” световой энергии называются квантами энергии.
Непрерывное волновое излучение нагретого тела действительно должно было бы иметь малую (фиолетовую) длину волны, в то время как излучение того же количества энергии как бы "зарядом картечи" из мелких порций энергии должно состоять (чисто статистически) из волн разной энергии, среди которых фиолетовые не обязательно в большинстве.
Можно привести такую аналогию. В некоем городе наступила небывалая жара и все люди на различных видах транспорта устремились за город, на природу. Наиболее быстро все могли бы выехать на легковых машинах, которые развивают наибольшую скорость. Но кто-то едет на автобусе, кто-то на велосипеде, кто-то на электричке. Если построить график в координатах: “число машин”-”скорость машин”, то выяснится, что очень быстроходных и очень тихоходных машин довольно мало, а основная масса людей передвигается за город не очень быстро, но и не очень медленно (рис. 2-14а).
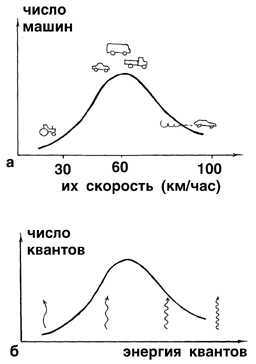
Рис. 2-14. а) График распределения машин в городе по скорости их движения: "лихачей" и "тихоходов" относительно мало, а основная масса водителей соблюдает обычный скоростной режим. б) Аналогичный график для квантов света, рождаемых “быстрыми” и “медленными” атомами по гипотезе Планка.
То же самое можно сказать об энергии, которая покидает нагреваемое тело в виде светового излучения (рис. 2-14б). Поскольку в нагретом теле одинаково мало как “быстрых”, так и “медленных” атомов, совершающих колебания, то излучаемый ими при каждом колебании свет содержит мало как коротко-, так и длинноволновых “порций” световой энергии. А основная масса энергии уносится из нагретого тела “порциями” света с электромагнитными волнами какой-то средней длины. Таким образом, тело испускает главным образом не фиолетовый, а, например, желтый свет.
Планк исходил из того, что свет испускается группами колеблющихся атомов (впоследствии оказалось, что это не так, но не помешало сделать правильный вывод о “порциях” световой энергии). Здесь важна идея не только о квантах энергии, но и об атомах - “квантах” материи, без которых невозможно представить образование квантов энергии.
Итак, по мнению Планка, в нагретом веществе группы атомов, колеблющихся с очень высокими (и очень низкими) частотами не могут составлять большинство (как не составляют большинство “лихачи” на дорогах), и основная масса порций энергии выделяется в области каких-то промежуточных, "средних" частот. Поэтому нагретый в горне металл (или раскаленная поверхность Солнца) при высоких температурах светятся белым (в белом есть кванты всех длин волн), но не фиолетовым светом.
Элементарная “порция” энергии e (эпсилон) связана с частотой электромагнитной световой волны, которая эту энергию несет, простым соотношением e = hn, где h - некоторая константа, необходимая уже для того, чтобы уравнять размерности энергии Е (джоуль) и частоты n (1/сек). Вспомните формулу E = kn, полученную в нашем опыте с океанскими волнами на рис. 2-10. Эта элементарная порция волновой энергии получила, как мы уже знаем, название кванта, а константа h называется постоянной Планка.
Сам Планк в 1900 году скромно называл свою гипотезу "математическим приемом" и "рабочим предположением". Он не скрывал, что был вынужден выдвинуть такую "странную" формальную гипотезу ради одного - чтобы любой ценой получился положительный результат. Это было нелегко сделать теоретику-классику, воспитанному на принципе "природа не делает скачков", в докторской диссертации которого за 20 лет до описываемых событий развивалась мысль о том, что атомистические взгляды на строение материи приводят к противоречиям.
В 1912 году на квантовую гипотезу обратил внимание датский физик Нильс Бор, который применил ее к модели атома Резерфорда и получил поразительные результаты в объяснении атомных спектров испускания водорода. Бор предположил, что электронный "рой" в модели Резерфорда не беспорядочен. Электроны в нем располагаются на строго определенных, постоянных орбитах (рис. 2-3в).
В модели Резерфорда электроны тоже двигались по орбитам, но эти орбиты могли быть "спиралевидными". Двигаясь по спирали ближе или дальше к ядру, атом мог излучать или поглощать энергию. В этом случае спектры испускания атомов должны были быть похожими на непрерывный солнечный спектр, а спектр испускания водорода оказался прерывистым, линейчатым (рис. 2-13).
Бор предложил считать аксиомой тот факт, что только на постоянных, стационарных орбитах электрон может существовать устойчиво, не падая на ядро. Объяснение этого феномена Бор откладывал до лучших времен, предлагая посмотреть, как новая модель объясняет экспериментальные факты. Постулаты Бора можно сформулировать следующим образом:
Дата добавления: 2016-11-04; просмотров: 5169;











