КОНСТАНТА РАВНОВЕСИЯ
Основным параметром, характеризующим обратимую реакцию, является константа равновесия. Т 1200 С
 Например:CO2+H2 CO+Н2О
Например:CO2+H2 CO+Н2О

Согласно закону действия масс
V1(пр.р)=k1[CO2]х[H2]
V2(обр.р.)=k2[CO]х[H2O]
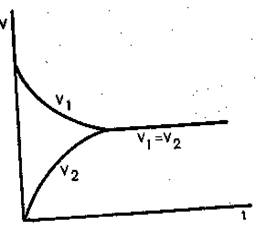
В начальный момент в реакционной смеси имеются только исходные реагенты(CO2 и Н2О); [ CO}= O и [H2O]=O,следовательно V2(обр.р.)=О.
По мере течения реакции [CO2] и [H2] уменьшается, а [ CO] и [H2O] возрастает. Следовательно, V1(пр.) будет убывать,а V2(обр) возрастать и наступит момент, когда V1=V2.
|
Рис 1.
Изменение скорости прямой и обратной реакции с течением времени (V1 – скорость прямой реакции, V2 – скорость обратной реакции)
Состояние системы реагирующих веществ, при котором скорости прямой и обратной реакции равны между собой, называется состоянием химического равновесия, т.е. V1=V2 k1[CO2]х[H2]=k2[CO]х[H2O]
k1 = [CO]х[H2O]
k2 [CO2х[H2]
k1
k2 = K [постоянная величина]
[CO] х [H2O] = К
[CO2] х [H2]
Константа химического равновесия (К) есть величина постоянная (отношение произведений концентраций образующихся веществ и веществ, вступающих в реакцию).
Сдвиг равновесия (смещение равновесия) – изменение равновесных концентраций реагирующих веществ, вызванное изменением какого-либо условия.
Увеличение концентрации образующихся веществ при изменении условий обратимой реакции называется смещением равновесия вправо.
Если изменение условия приводит к увеличению концентраций исходящих веществ – смещение равновесия влево.
При увеличении концентрации какого-либо из веществ. участвующих в обратимой реакции, равновесие смещается в сторону расхода этого вещества
 СО2+Н2 СО+Н2О
СО2+Н2 СО+Н2О
При добавлении СО2, не изменяя общего объема смеси газов, Vпр.р станет больше.
Увеличение [CO] и [H2O] вызывает ускорение V обр.р. Через некоторое время установится новое состояние равновесия, но при этом [CO] и [H2] будет выше, чем до добавления СО2.
Происходит смещение химического равновесия вправо.
Прибавление одного из образующихся при реакции веществ повысит скорость обратной реакции и происходит смещение химического равновесия влево.
Изменение температуры – повышение температуры может ускорять и прямой и обратный процессы.
Реакция экзотермическая, т.е. протекает с выделением теплоты, охлаждение вызовет смещение химического равновесия вправо – в сторону образования продуктов реакции.
Реакция эндотермическая, т.е.протекает с поглощением теплоты, то скорость прямой реакции будет увеличивать нагревание.
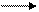 Например: N2+3H2 2NH3 ( Н< O)
Например: N2+3H2 2NH3 ( Н< O)
Реакция идет с выделением теплоты, повышение температуры смеси
Смещает равновесие влево; понижение температуры вызовет смещение
Равновесия вправо.
 N2O2 2NO( Н>O)
N2O2 2NO( Н>O)
Понижение температуры - смещение вправо;
Повышение температуры - смещение влево.
Принцип смещения равновесия (принцип Ле-Шателье): если изменить одно из условий , при которых система находится в равновесии и, таким образом нарушить равновесие, то в системе возникают процессы, которые ведут к восстановлению равновесия.
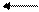
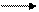 Например: N2+3H2 2NH3
Например: N2+3H2 2NH3
4 молекулы 2 молекулы
При увеличении давления равновесие смещается вправо; при уменьшении давления – влево.
 СО2 +Н2 СО + Н2О
СО2 +Н2 СО + Н2О
 2молекулы 2 молекулы
2молекулы 2 молекулы
Изменение давления не вызывает смещения равновесия.
Дата добавления: 2016-11-04; просмотров: 2089;











