Внутренняя энергия и энтальпия
Внутренняя энергия «U» - это вся энергия, заключенная в теле или системе тел. Её можно представить как сумму кинетической энергии молекул, энергии электронов, внутриядерной энергии, энергии взаимодействия между ядром молекулы и электронами, потенциальной энергии или энергии положения молекул в каком либо внешнем поле сил, энергии электромагнитного излучения. Поскольку абсолютное значение внутренней энергии методами термодинамики определить невозможно, то при анализе оценивается её изменение в результате происходящих процессов.
В отличие от теплоты и работы, она является функцией состояния системы. Ее величина может быть рассчитана из уравнения состояния, если известны два параметра.
Для простой термодеформационной системы
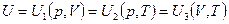
Абсолютная величина внутренней энергии, в общем случае, термодинамику не интересует, а интересует изменение внутренней энергии в некотором процессе. Ноль отсчета внутренней энергии может быть выбран произвольно. Изменение внутренней энергии может быть различно для простых и для сложных систем. Как функция состояния U обладает следующими свойствами:
1) 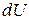 – обладает свойствами полного дифференциала, это бесконечно малое изменение внутренней энергии;
– обладает свойствами полного дифференциала, это бесконечно малое изменение внутренней энергии;
2) для того чтобы рассчитать изменение внутренней энергии в некотором процессе надо взять интеграл от dU
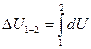
Изменение энергии в конечном процессе не зависит от характера процесса, от пути перехода из одного состояния в другое.
3) для идеального газа, для простых систем внутренняя энергия, как показали опыты Джоуля зависит только от температуры. Внутренняя энергия реальных газов может зависеть еще от давления.
4) т.к. dU обладает свойствами полного дифференциала, то интеграл по замкнутому контуру равен
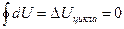 ,
,
т.е. в цикле внутренняя энергия не изменяется.
Энтальпия «I»– полное энергосодержание
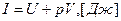 ;
;
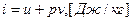 ;
;
где 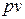 – потенциальная энергия давления (возможной работы газа, которую необходимо затратить, чтобы тело объемом V ввести во внешнюю среду, находящуюся под давлением р).
– потенциальная энергия давления (возможной работы газа, которую необходимо затратить, чтобы тело объемом V ввести во внешнюю среду, находящуюся под давлением р).
Т.к. энтальпия есть комплекс составленный из функций (параметров состояния), то она обладает свойствами функции (параметра состояния), т.е. свойствами внутренней энергии. Функция процесса зависит от параметров, а не от процесса.
Свободная энергия «F» (изохорно-изотермический потенциал или энергия Гельмгольца)– часть внутренней энергии, которую можно перевести в работу.
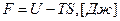 ;
;
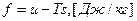
Где 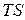 – связанная часть внутренней энергии (ее невозможно превратить в работу).
– связанная часть внутренней энергии (ее невозможно превратить в работу).
Свободная энтальпия «G» (изобарно-изотермический потенциал или энергия Гиббса) – часть энтальпии, которую можно перевести в работу.
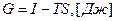 ;
;
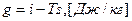 ;
;
Свободная энергия и свободная энтальпия являются комплексами, составленными из параметров состояния следовательно они обладают теми же свойствами, что и функции (параметры) состояния (теми же, что и внутренняя энергия).
Дата добавления: 2020-03-21; просмотров: 975;











