Определение термодинамических параметров реакции, протекающей в гальваническом элементе
Для обратимо работающего гальванического элемента при Р и Т = const изменение энергии Гиббса 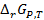 равно максимальной полезной работе W, взятой с обратным знаком
равно максимальной полезной работе W, взятой с обратным знаком 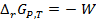 . С другой стороны, электрическая работа, связанная с переносом заряда, соответствующего одному молю вещества, между электродами с разностью потенциалов Е (ЭДС), равна
. С другой стороны, электрическая работа, связанная с переносом заряда, соответствующего одному молю вещества, между электродами с разностью потенциалов Е (ЭДС), равна 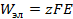 (см. выражение (3.5)).
(см. выражение (3.5)).
В результате получим выражение:
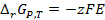 (3.14)
(3.14)
Изменение энтропии, характеризующее электрохимическую реакцию, равно
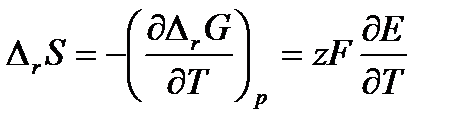 (3.15)
(3.15)
Из термодинамики известно, что
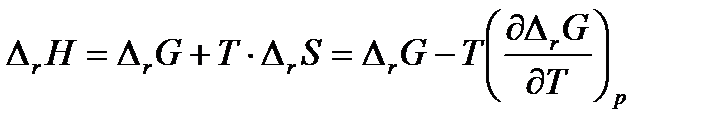 (3.16)
(3.16)
Подставим в уравнение (3.16) уравнение (3.14), преобразуем и получим:
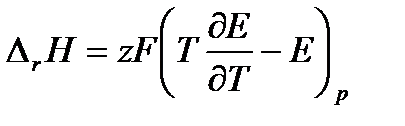 (3.17)
(3.17)
Последнее уравнение является одной из форм уравнения Гиббса – Гельмгольца и позволяет рассчитать тепловой эффект реакции, протекающей в элементе, если известны его электродвижущая сила и температурный коэффициент ЭДС 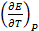 . Знак
. Знак 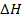 связан со знаком температурного коэффициента ЭДС. Действительно,
связан со знаком температурного коэффициента ЭДС. Действительно, 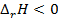 (теплота выделяется), если
(теплота выделяется), если 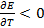 или
или 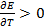 , но
, но 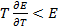 . Энтальпия увеличивается (
. Энтальпия увеличивается ( 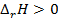 ), если
), если 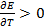 и
и 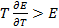 . В последнем случае элемент работает с поглощением теплоты из окружающей среды. Если
. В последнем случае элемент работает с поглощением теплоты из окружающей среды. Если 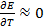 , то
, то 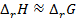 , т.е. в этом случае все тепло практически можно превратить в работу, и коэффициент полезного действия такого элемента приближается к 100%.
, т.е. в этом случае все тепло практически можно превратить в работу, и коэффициент полезного действия такого элемента приближается к 100%.
При достижении равновесия при Т, Р = const изменение энергии Гиббса равно нулю и для термодинамической константы равновесия электро-химической реакции, протекающей в гальваническом элементе, справедливо:
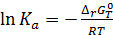 , (3.18)
, (3.18)
где 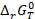 – изменение энергии Гиббса химической реакции, протекающей при условии, что активности всех компонентов равны единице. По определению стандартный потенциал электрода – это потенциал при активностях окисленной и восстановленной формы равных единице. Стандартная ЭДС – разность стандартных потенциалов. Следовательно,
– изменение энергии Гиббса химической реакции, протекающей при условии, что активности всех компонентов равны единице. По определению стандартный потенциал электрода – это потенциал при активностях окисленной и восстановленной формы равных единице. Стандартная ЭДС – разность стандартных потенциалов. Следовательно,
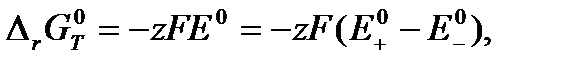 (3.19)
(3.19)
где 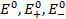 – стандартная ЭДС и стандартные потенциалы положительного и отрицательного электродов, соответственно.
– стандартная ЭДС и стандартные потенциалы положительного и отрицательного электродов, соответственно.
Пример: Составим элемент, в котором обратимо протекает реакция:
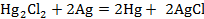
Используя стандартную ЭДС этого элемента рассчитаем стандартные термодинамические функции этой реакции, константу равновесия при температуре 325 К, если температурный коэффициент стандартной ЭДС составляет 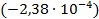 В/К.
В/К.
Решение: Сначала нужно выяснить, из каких электродов состоит гальванический элемент, на котором протекает данная реакция.
В данной реакции серебро окисляется, повышая свою степень окисления, а 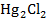 восстанавливается, понижая свою степень окисления. Хлорид серебра
восстанавливается, понижая свою степень окисления. Хлорид серебра 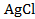 и каломель
и каломель 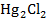 , участвующие в реакции, являются малорастворимыми соединениями (см. таблицу 78 справочника [2]), следовательно, они входят в состав электродов второго рода: хлорсеребрянного и каломелевого.
, участвующие в реакции, являются малорастворимыми соединениями (см. таблицу 78 справочника [2]), следовательно, они входят в состав электродов второго рода: хлорсеребрянного и каломелевого.
Запишем электродные реакции, протекающие на электродах с учетом стехиометрических коэффициентов заданной реакции:
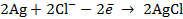
и
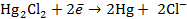
В суммарной реакции участвуют 2 электрона ( 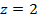 ).
).
Электрод, на котором протекает реакция окисления (хлорсеребрянный), будет располагаться на схеме гальванического элемента слева, а электрод, на котором идет реакция восстановления (каломелевый), - справа.
Электроды второго рода обязательно включают в себя хорошо растворимое соединение с анионом, одноименным аниону малорастворимого соединения. Поэтому хорошо растворимое соединение нужно включить в схему гальванического элемента, несмотря на то, что оно не входит в суммарную реакцию.
Гальванический элемент можно представить в виде гальванического элемента с переносомионов через границу раздела жидких фаз (т.е., с двумя жидкими фазами, между которыми располагается мембрана или электролитический мостик):
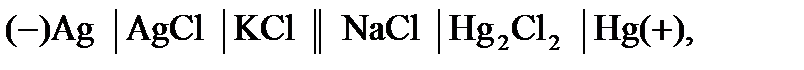
или без переноса ионов через границу раздела жидких фаз (с одной жидкой фазой, общей для двух электродов):
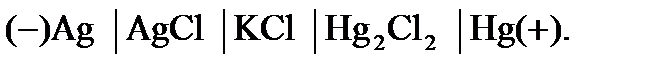
В таблице 79 [2] найдем стандартные потенциалы хлорсеребрянного и каломелевого электродов: +0,222 В и +0,268 В, соответственно. Стандартная ЭДС данного гальванического элемента при Т = 298 К:
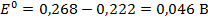
Используя температурный коэффициент ЭДС 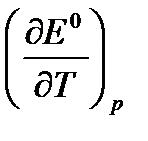 и приняв, что в указанном интервале температур зависимость Е0 = f(T) линейна, найдем:
и приняв, что в указанном интервале температур зависимость Е0 = f(T) линейна, найдем:
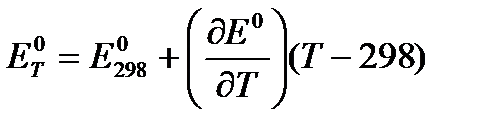
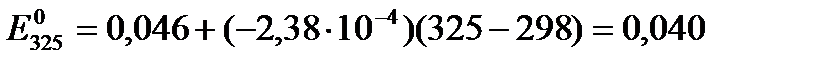 В.
В.
По формуле (3.19) найдем 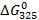 :
:
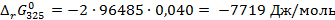
Термодинамическую константу равновесия найдем из формулы (3.18):
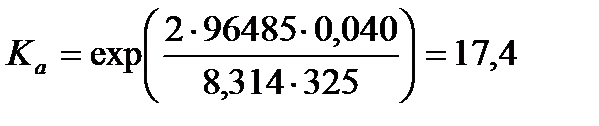
Далее по формулам (3.15) и (3.16) рассчитаем изменение энтропии и тепловой эффект реакции при 325 К:
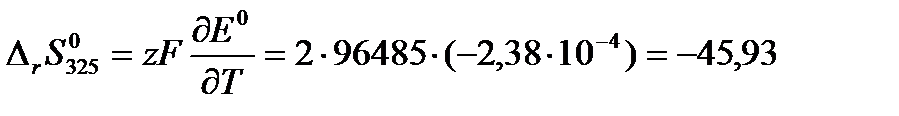 Дж/(моль·К)
Дж/(моль·К)
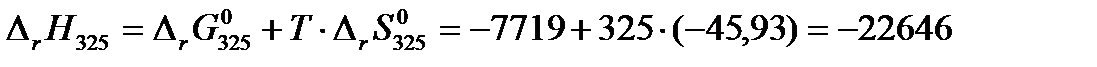 Дж/моль.
Дж/моль.
3.1.4 Многовариантное задание №8 «Гальванические элементы»
1. Какого рода левый электрод гальванического элемента А (таблица 3.1)? Напишите уравнение реакции, протекающей на этом электроде в равновесных условиях, и уравнение для расчета потенциала этого электрода.
2. Определите среднюю ионную активность электролита a± в левом электроде гальванического элемента А на основании справочных значений среднего ионного коэффициента активности электролита [2] при моляльной концентрации m1(таблица 3.2) и температуре 298 К.
3. Определите электродный потенциал левого электрода при 298 К. Стандартный электродный потенциал возьмите из справочника [2]. Давление в газовых электродах примите равным стандартному атмосферному давлению.
4. Какого рода правый электрод гальванического элемента А (таблица 3.1)? Напишите уравнение реакции, протекающей на этом электроде в равновесных условиях, и уравнение для расчета потенциала этого электрода
5. Определите среднюю ионную активность электролита a± в правом электроде гальванического элемента А на основании справочных значений среднего ионного коэффициента активности электролита [2] при моляльной концентрации m2 (таблица 3.2) и температуре 298 К.
6. Определите электродный потенциал правого электрода при 298 К. Стандартный электродный потенциал возьмите из справочника [2]. Давление в газовых электродах примите равным стандартному атмосферному давлению.
7. Напишите электродные реакции, протекающие на отрицательном и положительном электродах и суммарную химическую реакцию, протекающую самопроизвольно при работе гальванического элемента А.
8. Определите электродвижущую силу (ЭДС) гальванического элемента А и максимальную полезную электрическую работу, которую можно получить при работе данного элемента при температуре 298 К.
9. Вычислите термодинамическую константу равновесия реакции, протекающей самопроизвольно в гальваническом элементе А при температуре 298 К.
10. Составьте гальванический элемент, в котором протекает самопроизвольно химическая реакция В (таблица 3.3).
11. Определите стандартное значение ЭДС гальванического элемента, в котором протекает химическая реакция В, при температуре 298 К на основании стандартных электродных потенциалов из справочника [2].
12. Определите Е0при температуре T на основании значения Е0 при 298 К и величины 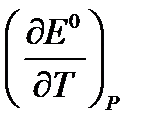 (таблица 3.3), приняв что в указанном интервале температур зависимость Е0 = f(T) линейна.
(таблица 3.3), приняв что в указанном интервале температур зависимость Е0 = f(T) линейна.
13. Определите 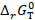 (кДж/моль) реакции В, протекающей в гальваническом элементе при температуре T (таблица 3.4).
(кДж/моль) реакции В, протекающей в гальваническом элементе при температуре T (таблица 3.4).
14. Определите 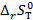 (Дж/(моль∙К)) для реакции В, протекающей в гальваническом элементе при температуре T.
(Дж/(моль∙К)) для реакции В, протекающей в гальваническом элементе при температуре T.
15. Определите тепловой эффект 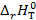 (кДж/моль) реакции В, протекающей в гальваническом элементе при температуре T.
(кДж/моль) реакции В, протекающей в гальваническом элементе при температуре T.
16. Определите термодинамическую константу равновесия химической реакции Впри температуре T.
Таблица 3.1 – Варианты заданий
| Вар. | Гальванический элемент А |
| Zn|ZnSO4||KCl|AgCl(s)|Ag | |
| (Pt)H2|H2SO4||KCl|Hg2Cl2(s)|Hg | |
| Cu|CuCl2||CdSO4|Hg2SO4(s)|Hg | |
| Pb|PbSO4|Na2SO4||HCl|H2(Pt) | |
| Fe|FeCl2||H2SO4|Ag2SO4(s)|Ag | |
| Pb|PbI2(s)|KI||SnCl2|Sn | |
| Cd|CdSO4||HCl|Cl2(Pt) | |
| Hg|Hg2SO4|CdSO4||AgNO3|Ag | |
| (Pt)H2|H2SO4||NaBr|AgBr(s)|Ag | |
| Cd|CdSO4||HCl|CuCl(s)|Cu | |
| Pb|Pb(NO3)2||KI|I2(Pt) | |
| Ni|NiSO4||KBr|Hg2Br2(s)|Hg | |
| Ca|Ca(OH)2(s)|NaOH||SnCl2|Sn | |
| Tl|TlCl||CdCl2|Cl2(Pt) | |
| Tl|TlI(s)|KI||CuSO4|Cu | |
| Tl|TlCl(s)|NaCl||BaCl2|Cl2(Pt) | |
| Cu|Cu2O(s)|KOH||KOH|O2(Pt) |
Продолжение таблицы 3.1
| Вар. | Гальванический элемент А |
| Pb|PbBr2(s)|NaBr||KBr|Br2(Pt) | |
| (Pt)H2|NaOH||NaCl|PbCl2(s)|Pb | |
| Cu|CuI(s)|NaI||CdCl2|Cl2(Pt) | |
| Li|LiCl||KI|AgI(s)|Ag | |
| Zn|ZnCl2||NaI|Hg2I2(s)|Hg | |
| Cd|CdI2||NaOH|HgO(s) |Hg | |
| Cs|CsCl||KOH|Ag2O(s)|Ag | |
| Cd|CdCl2||HCl|Sb2O3(s)|Sb | |
| Cd|CdSO4||KI|I2(Pt) |
Таблица 3.2 – Варианты заданий
| Вариант | Моляльная концнентрация растворов, m, моль/кг H2O | Подвариант | |||||
| 1, 2, 3, 4, 7, 9, 15, 18, 26 | m1 m2 | 0,005 0,2 | 0,01 0,1 | 0,02 0,05 | 0,05 0,02 | 0,1 0,01 | 0,2 0,005 |
| 12, 17, 19, 20, 22, 23, 24 | m1 m2 | 0,1 0,5 | 0,2 2,0 | 0,5 1,0 | 1,0 0,5 | 2,0 0,2 | 0,5 0,1 |
| 5, 6, 10, 13, 16, 21 | m1 m2 | 0,01 0,1 | 0,02 0,05 | 0,05 0,02 | 0,1 0,01 | 0,2 0,005 | 0,5 0,001 |
| 8, 11, 14, 25 | m1 m2 | 0,001 0,05 | 0,002 0,1 | 0,01 0,02 | 0,001 0,2 | 0,002 0,5 | 0,01 1,0 |
Таблица 3.3 – Варианты заданий
| Вариант | Химическая реакция В | 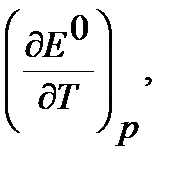 В/К В/К
|
| Pb + 2AgI = PbI2 + 2Ag | 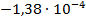
| |
| Cd + 2AgCl = CdCl2 + 2Ag | 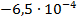
| |
| Cd + PbCl2 = CdCl2 + Pb | 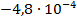
| |
| Cd + Hg2SO4 = CdSO4 + 2Hg | 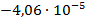
| |
| H2 + Hg2SO4 = H2SO4 +2Hg | 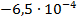
| |
| Zn + Hg2SO4 = ZnSO4 +2Hg | 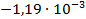
| |
| Pb + 2AgI = PbI2 + 2Ag | 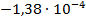
| |
| Cd + 2AgCl = CdCl2 + 2Ag | 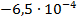
| |
| Cd + PbCl2 = CdCl2 + Pb | 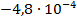
| |
| Cd + Hg2SO4 = CdSO4 + 2Hg | 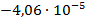
| |
| H2 + Hg2SO4 = H2SO4 +2Hg | 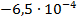
| |
| Zn + Hg2SO4 = ZnSO4 +2Hg | 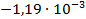
| |
| Ni + 2CoCl3 = NiCl2 + 2CoCl2 | 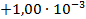
| |
| FeCl3 + 3CrCl2 = Fe + 3CrCl3 | 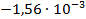
| |
| Zn + 2TlOH = Zn(OH)2 + 2Tl | 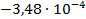
| |
| Tl + Cu(NO3)2 = TlNO3 + CuNO3 | 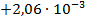
| |
| Zn + 2FeCl3 = ZnCl2 + 2FeCl2 | 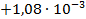
| |
| NaI3 +Na2S = 3NaI +S | 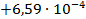
| |
| Fe + Tl(NO3)3 = Fe(NO3)2 + TlNO3 | 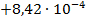
| |
| Ni + 2CoCl3 = NiCl2 + 2CoCl2 | 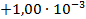
| |
| FeCl3 + 3CrCl2 = Fe + 3CrCl3 | 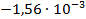
| |
| Zn + 2TlOH = Zn(OH)2 + 2Tl | 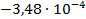
| |
| Tl + Cu(NO3)2 = TlNO3 + CuNO3 | 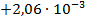
| |
| Zn + 2FeCl3 = ZnCl2 + 2FeCl2 | 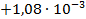
| |
| Fe + Tl(NO3)3 = Fe(NO3)2 + TlNO3 | 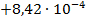
| |
| Hg2Cl2 +2Ag = 2AgCl + 2Hg | 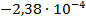
|
Таблица 3.4 – Варианты заданий
| Вариант | Температура T, К | |||||
| Подвариант | ||||||
| 1, 2, 3, 4, 5, 6, 13, 14, 15, 16, 17, 18, 19, 26 | ||||||
| 7, 8, 9, 10, 11, 12, 20, 21, 22, 23, 24, 25 |
Дата добавления: 2021-01-26; просмотров: 968;











