Общая характеристика молекулярных спектров
Спектромназывается последовательность квантов энергии электромагнитного излучения, поглощенных, выделившихся, рассеянных или отраженных веществом при переходах атомов и молекул из одних энергетических состояний в другие.
В зависимости от характера взаимодействия света с веществом спектры можно разделить на спектры поглощения (абсорбционные); испускания (эмиссионные); рассеяния и отражения.
По изучаемым объектам оптическая спектроскопия, т.е. спектроскопия в области длин волн 10-3÷10-8м подразделяется на атомную и молекулярную.
Атомный спектрпредставляет собой последовательность линий, положение которых определяется энергией перехода электронов с одних уровней на другие.
Энергию атомаможно представить как сумму кинетической энергии поступательного движения  и электронной энергии
и электронной энергии 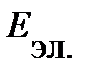 :
:
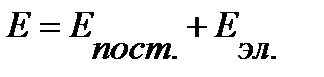 . .
| (4.10) |
Последняя составляющая квантуется и, следовательно, отражается в спектрах. Величина кванта 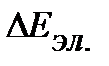 связана с положением линии в спектре:
связана с положением линии в спектре:
 , ,
| (4.11) |
где 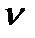 - частота,
- частота,  - длина волны,
- длина волны, 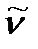 - волновое число,
- волновое число,  - скорость света,
- скорость света, 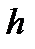 - постоянная Планка.
- постоянная Планка.
Так как энергия электрона в атоме обратно пропорциональна квадрату главного квантового числа  , то для
, то для 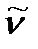 линии в атомном спектре можно записать уравнение:
линии в атомном спектре можно записать уравнение:
 . .
| (4.12) |
Здесь 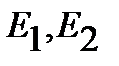 - энергии электрона на более высоком и более низком уровнях;
- энергии электрона на более высоком и более низком уровнях; 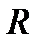 - постоянная Ридберга;
- постоянная Ридберга; 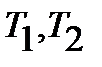 - спектральные термы, выраженные в единицах измерения волновых чисел (м-1, см-1).
- спектральные термы, выраженные в единицах измерения волновых чисел (м-1, см-1).
Все линии атомного спектра сходятся в коротковолновой области к пределу, определенному энергией ионизации атома, после которого идет сплошной спектр.
Энергию молекулыв первом приближении можно рассмотреть как сумму поступательной, вращательной, колебательной и электронной энергий:
 . .
| (4.13) |
Если не рассматривать поступательную составляющую энергии, которая не отражается в спектре, то вклады отдельных составляющих сильно отличаются по величине:
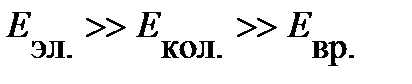
| (4.14) |
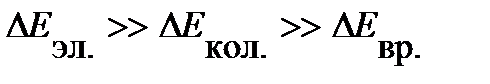
| (4.15) |
.
Для большинства молекул такое условие выполняется. Например, для Н2 при 291К отдельные составляющие полной энергии различаются на порядок и более:
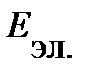 = 309,5 кДж/моль,
= 309,5 кДж/моль,
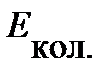 = 25,9 кДж/моль,
= 25,9 кДж/моль,
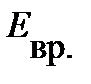 = 2,5 кДж/моль,
= 2,5 кДж/моль,
 = 3,8 кДж/моль.
= 3,8 кДж/моль.
Значения энергии квантов в различных областях спектра сопоставлены в таблице 4.2.
Таблица 4.2 - Энергия поглощенных квантов 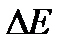 различных областей оптического спектра молекул
различных областей оптического спектра молекул
| Область спектра |  ,кДж/моль ,кДж/моль
| Молекулярные процессы – причина поглощения |
| микроволновая | 0,0012-0,12 | вращение молекул |
| дальняя ИК | 0,12-2,4 | |
| средняя ИК | 2,4-60 | колебания ядер |
| ближняя ИК | 60-155 | |
| видимая | 155-300 | переходы валентных электронов |
| ближний УФ | 300-598 | |
| дальний УФ | 598-12000 |
Понятия «колебания ядер» и «вращение молекул» являются условными. В действительности такие виды движения лишь очень приближенно передают представления о распределении ядер в пространстве, которое носит такой же вероятностный характер, что и распределение электронов.
Схематичная система уровней энергии в случае двухатомной молекулы представлена на рисунке 4.1.
Переходы между вращательными уровнями энергии приводит к появлению вращательных спектров в дальней ИК и микроволновой областях. Переходы между колебательными уровнями в пределах одного электронного уровня дают колебательно-вращательные спектры в ближней ИК области, поскольку изменение колебательного квантового числа 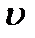 неминуемо влечет за собой изменение и вращательного квантового числа
неминуемо влечет за собой изменение и вращательного квантового числа  . Наконец, переходы между электронными уровнями вызывают появление в видимой и УФ областях электронно-колебательно-вращательных спектров.
. Наконец, переходы между электронными уровнями вызывают появление в видимой и УФ областях электронно-колебательно-вращательных спектров.
В общем случае число переходов может быть очень велико, но на самом деле в спектрах проявляются далеко не все. Количество переходов ограничено правилами отбора.
Молекулярные спектры дают богатую информацию. Они могут быть использованы:
- для идентификации веществ в качественном анализе, т.к. каждое вещество имеет свой собственный только ему присущий спектр;
- для количественного анализа;
- для структурно-группового анализа, поскольку определенные группы, такие, например, как >С=О, _NH2, _OH и др. дают в спектрах характеристические полосы;
- для определения энергетических состояний молекул и молекулярных характеристик (межъядерное расстояние, момент инерции, собственные частоты колебаний, энергии диссоциации); комплексное изучение молекулярных спектров позволяет сделать выводы о пространственном строении молекул;
- в кинетических исследованиях, в том числе для изучения очень быстрых реакций.

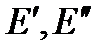 - энергии электронных уровней;
- энергии электронных уровней;
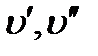 - энергии колебательных уровней;
- энергии колебательных уровней;
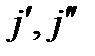 - энергии вращательных уровней
- энергии вращательных уровней
Рисунок 4.1 – Схематичное расположение уровней энергии двухатомной молекулы
Дата добавления: 2021-01-26; просмотров: 717;











