Электроды второго рода
Электроды второго рода – это трехфазные электроды, представляющие собой металл, покрытый труднорастворимым соединением этого металла, находящимся в контакте с раствором электролита с анионом, одноименным с анионом труднорастворимого соединения металла (если малорастворимым соединением металла является его оксид, то анионом хорошо растворимого соединения является ион 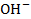 ).
).
Примерами электродов второго рода являются хлорсеребряный электрод 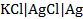 ; каломелевый электрод
; каломелевый электрод 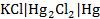 . Такие электроды обратимы относительно и катиона, и аниона.
. Такие электроды обратимы относительно и катиона, и аниона.
Рассмотрим хлорсеребряный электрод.
Электродная реакция:
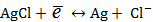 .
.
Потенциал (Т = 298К):
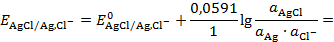
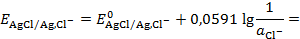
= 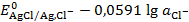 , (3.10)
, (3.10)
где 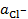 определяется средней ионной активностью КCl a±, KCl.
определяется средней ионной активностью КCl a±, KCl.
Электродную реакцию, протекающую в хлорсеребряном электроде можно записать в две стадии:
Ag – 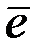 ↔ Ag+
↔ Ag+
Ag+ + 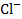 ↔ AgCl
↔ AgCl
Потенциалопределяющей реакцией является первая стадия. Тогда равновесный потенциал хлорсеребряного электрода можно выразить как потенциал электрода первого рода:
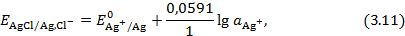
Активность иона Ag+ определяется произведением растворимости труднорастворимой соли LAgCl , т.е.
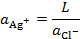
Тогда:
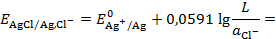
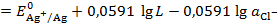
Откуда следует, что
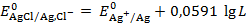
Электроды второго рода, например, хлорсеребряный и каломелевый, применяются в качестве электродов сравнения, т.к. они имеют стабильное, хорошо воспроизводимое значение потенциала.
Пример: Рассчитаем электродный потенциал каломелевого электрода 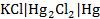 , если моляльность раствора хлорида калия равна 0,1 моль/кг H2O.
, если моляльность раствора хлорида калия равна 0,1 моль/кг H2O.
Решение: Сначала запишем электродную реакцию, протекающую по твердофазному механизму:
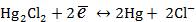
Число электронов, участвующих в электродной реакции, 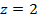 .
.
Потенциал такого электрода при T=298K:
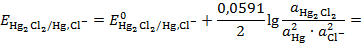
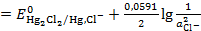 =
= 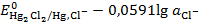 (3.12)
(3.12)
Активность иона 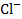 равна средней ионной активности хлорида калия:
равна средней ионной активности хлорида калия:
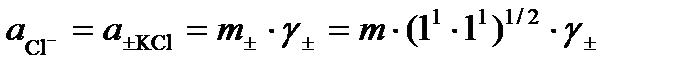
Средний ионный коэффициент активности 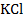 находим по таблице 72 [2] для заданной моляльности:
находим по таблице 72 [2] для заданной моляльности: 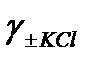 = 0,770.
= 0,770.
В результате получим:
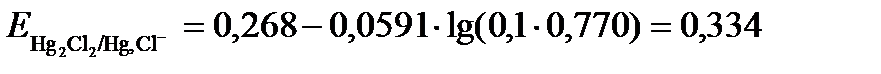 В
В
Дата добавления: 2021-01-26; просмотров: 1007;











