Второе начало термодинамики
Одной из важнейших задач химической термодинамики является выяснение принципиальной возможности (или невозможности) самопроизвольного протекания химической реакции в рассматриваемом направлении. В тех случаях, когда становится ясно, что данное химическое взаимодействие происходить может, необходимо определить степень превращения исходных веществ и выход продуктов реакции, то есть полноту протекания реакции
Направление протекания самопроизвольного процесса можно определить на основе второго закона или начала термодинамики, сформулированного, например, в виде постулата Клаузиуса:
Теплота сама собой не может переходить от холодного тела к горячему, т. е. невозможен такой процесс, единственным результатом которого был бы переход теплоты от тела с более низкой температурой к телу с более высокой температурой.
Предложено множество формулировок второго начала термодинамики. Формулировка Томсона - Планка:
Невозможен вечный двигатель второго рода, т. е. невозможна такая периодически действующая машина, которая бы позволяла получать работу только за счет охлаждения источника тепла.
Математическая формулировка второго начала термодинамики возникла при анализе работы тепловых машин в трудах Н. Карно и Р. Клаузиуса.
Клаузиусом была введена функция состояния S, названная энтропией, изменение которой равно теплоте обратимого процесса, отнесенной к температуре
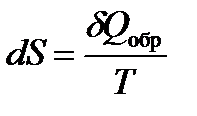
| (1.21) |
Так как теплота необратимого процесса меньше теплоты обратимого процесса
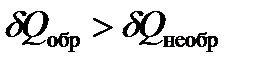
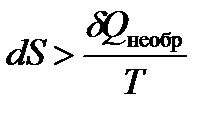
| (1.21а) |
Для любого процесса
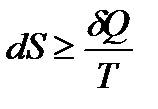
| (1.22) |
Полученное выражение представляет собой математическое выражение второго начала термодинамики.
Дата добавления: 2021-01-26; просмотров: 677;











