Распределение скоростей молекул по Максвеллу.
Молекулы идеального газа совершают беспорядочное тепловое движение. Ввиду полной беспорядочности движения молекул и огромного их числа нет возможности судить о скорости каждой молекулы в любой момент времени. Возможно определить лишь число молекул, скорости которых лежат в определенном интервале скоростей.
Теоретически задачу о распределении молекул идеального газа по скоростям поступательного движения решил Максвелл. Он показал, что число молекул, имеющих малые скорости и большие скорости относительно мало. Оказывается, что скорости большинства молекул лежат в окрестности некоторой средней скорости. С помощью теории вероятностей (1859) Максвеллу удалось вывести формулу для относительной частоты, с которой в газе при данной температуре встречаются молекулы со скоростями в определенном интервале значений.
Если N - общее число молекул газа, dN - число молекул, скорости которых заключены в интервале от v до v+dv, то закон распределения Максвелла запишется в виде:
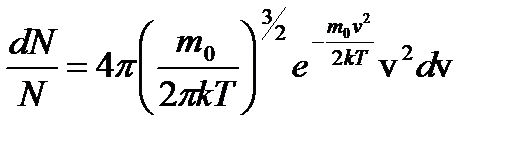 (1)
(1)
 По определению плотности вероятности
По определению плотности вероятности 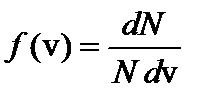 , поэтому здесь
, поэтому здесь 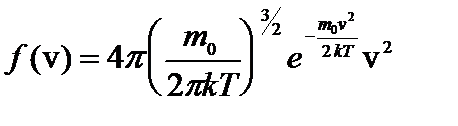 (2)
(2)
– функция распределения. Она указывает долю молекул dN/N, обладающих скоростями, лежащими в интервале dv около значения скорости v. Из этой формулы видно, что конкретный вид функции зависит от рода газа (m0) и от параметров состояния (Т).
График функции распределения приведен на рис.32.1. Так как при возрастании v множитель 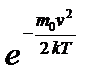 уменьшается быстрее, чем растет множитель v2, то функция
уменьшается быстрее, чем растет множитель v2, то функция 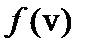 , начинаясь от нуля, достигает максимума при vв и затем асимптотически стремится к нулю. Положение максимума характеризует наиболее часто встречающуюся скорость, которую называют наиболее вероятной скоростью vв. Скорости, превышающие vв, встречаются чаще, чем меньшие скорости. Кривая асимметрична относительно vв. Относительное число молекул, скорости которых находятся в интервале от v до v+dv, находится как площадь заштрихованной полоски. Площадь, ограниченная кривой распределения и осью абсцисс, равна единице. Это означает, что f(v) удовлетворяет условию нормировки:
, начинаясь от нуля, достигает максимума при vв и затем асимптотически стремится к нулю. Положение максимума характеризует наиболее часто встречающуюся скорость, которую называют наиболее вероятной скоростью vв. Скорости, превышающие vв, встречаются чаще, чем меньшие скорости. Кривая асимметрична относительно vв. Относительное число молекул, скорости которых находятся в интервале от v до v+dv, находится как площадь заштрихованной полоски. Площадь, ограниченная кривой распределения и осью абсцисс, равна единице. Это означает, что f(v) удовлетворяет условию нормировки: 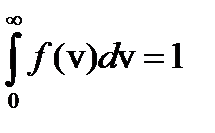 .
.
Значение наиболее вероятной скорости vв находят, исследуя f(v) на экстремум: 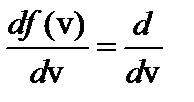
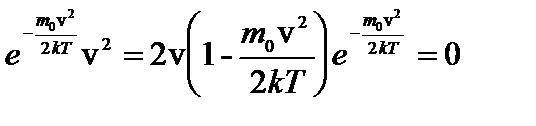 .
.
 Значения v=0 и v=¥ соответствуют минимумам распределения (1), а значение v, при котором выражение в скобках равно нулю, и есть наиболее вероятная скорость: vв=
Значения v=0 и v=¥ соответствуют минимумам распределения (1), а значение v, при котором выражение в скобках равно нулю, и есть наиболее вероятная скорость: vв= 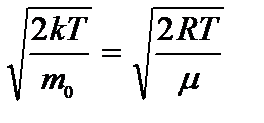 . Из полученной формулы видно, что с повышением температуры газа максимум кривой распределения смещается в сторону больших скоростей. Однако площадь, ограниченная кривой остается неизменной, поэтому при повышении температуры кривая распределения молекул по скоростям будет растягиваться и понижаться, то есть наиболее вероятная скорость возрастает, а доля молекул, обладающих этой скоростью, уменьшается (рис. 32.2).
. Из полученной формулы видно, что с повышением температуры газа максимум кривой распределения смещается в сторону больших скоростей. Однако площадь, ограниченная кривой остается неизменной, поэтому при повышении температуры кривая распределения молекул по скоростям будет растягиваться и понижаться, то есть наиболее вероятная скорость возрастает, а доля молекул, обладающих этой скоростью, уменьшается (рис. 32.2).
Если выразить скорости молекул не в обычных единицах, а в относительных, приняв за единицу скорости наиболее вероятную скорость молекул, то распределение Максвелла принимает вид: 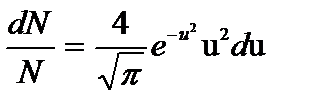 ,
,
где u=v/vи – относительная скорость молекул.
Средняя скорость молекулы `v (средняя арифметическая скорость) определяется из условия: 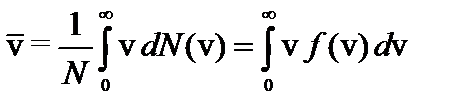 .
.
Подставляя сюда f(v) и интегрируя, получаем: 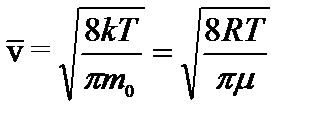
Итак, различают следующие характерные скорости молекул газа:
 1)наиболее вероятная скорость vв =
1)наиболее вероятная скорость vв = 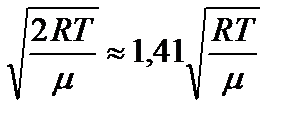 ;
;
2) средняя арифметическая скорость 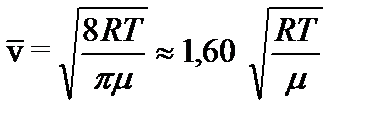 ;
;
3)средняя квадратичная скоростьvкв= 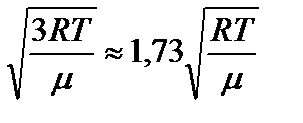 .
.
Последовательность расположения указанных выше скоростей представлена на графике рис.32.3.
Дата добавления: 2016-10-26; просмотров: 4121;











