Газовые законы. Уравнение Менделеева-Клапейрона.
 Экспериментальное исследование свойств газов, проведенное в ХVII-XVIII вв. Бойлем, Мариоттом, Гей-Люссаком, Шарлем, привело к формулировке газовых законов:
Экспериментальное исследование свойств газов, проведенное в ХVII-XVIII вв. Бойлем, Мариоттом, Гей-Люссаком, Шарлем, привело к формулировке газовых законов:
1. Изотермический процесс – Т=const. Закон Бойля-Мариотта: pV=const – уравнение изотермы.
График зависимости p от V приведен на рисунке 31.1. Чем выше изотерма, тем более высокой температуре она соответствует, T2>T1.
 2. Изобарный процесс – p=const. Закон Гей-Люссака:
2. Изобарный процесс – p=const. Закон Гей-Люссака: 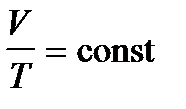 – уравнение изобары. График зависимости V от T приведен на рисунке 31.2. Чем ниже к оси температуры наклонена изобара, тем большему давлению она соответствует, р2 > p1.
– уравнение изобары. График зависимости V от T приведен на рисунке 31.2. Чем ниже к оси температуры наклонена изобара, тем большему давлению она соответствует, р2 > p1.
 3. Изохорический процесс– V=const. Закон Шарля:
3. Изохорический процесс– V=const. Закон Шарля: 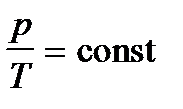 – уравнение изохоры. График зависимости р от Т изображен на рисунке 31.3. Чем ниже к оси температуры наклонена изохора, тем большему объему она соответствует, V2 > V1.
– уравнение изохоры. График зависимости р от Т изображен на рисунке 31.3. Чем ниже к оси температуры наклонена изохора, тем большему объему она соответствует, V2 > V1.
Комбинируя выражения газовых законов, получим уравнение, связывающее р, V, Т : 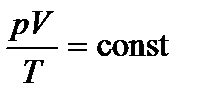 .
.
Постоянная в этом уравнении определяется экспериментально. Для 1 моль газа она оказалась равной R=8,31 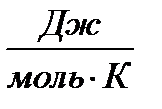 и была названа универсальной газовой постоянной.
и была названа универсальной газовой постоянной.
1 моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. Число молекул (структурных единиц) в 1 моле равно числу Авогадро: NA=6,02.1023моль-1. Для R справедливо соотношение: R=k NA
Итак, для одного моля: 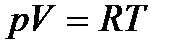 .
.
Для произвольного количества газа n = m/m (уравнение Менделеева-Клапейрона): 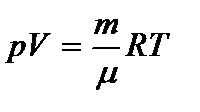 , где m - молярная масса газа.
, где m - молярная масса газа.
Установим связь между уравнением кинетической теории газов и уравнением Менделеева-Клапейрона: 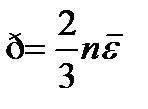 ,
, 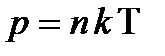 .
.
Так как n=N/V, то 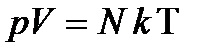 .
.
Для количества вещества справедливо соотношение 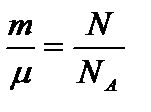 , а для постоянной Больцмана k = R /NA, поэтому последнее уравнение можно записать в виде:
, а для постоянной Больцмана k = R /NA, поэтому последнее уравнение можно записать в виде: 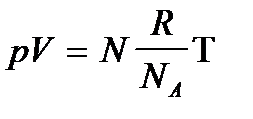 или
или 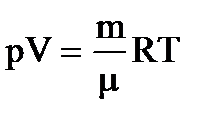 .
.
Дата добавления: 2016-10-26; просмотров: 2154;











