ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Окислителем при электрохимической коррозии металлов может быть растворенный в воде кислород. В этом случае говорят, что коррозия протекает с кислородной деполяризацией:
О2 + 4Н+ + 4е = 2Н2О ( рН=0) Ео= +1,228 В
О2 + 2Н2О + 4е = 4ОН- (рН=7) Ео= +0,81 В
О2 + 2Н2О + 4е = 4ОН- (рН=14) Ео= +0,401 В
Таким образом, в кислой среде подвергаться коррозии с кислородной деполяризацией могут металлы, стандартный электродный потенциал которых отрицательнее +1,23 В, в нейтральной +0,81 и щелочной – отрицательнее + 0,4В.
Активные металлы в кислой среде корродируют с водородной деполяризацией, т.е в качестве окислителя выступают свободные ионы водорода:
2Н+ + 2е = Н2 (рН =0) Ео = 0 В
Наиболее простой моделью коррозионного процесса, идущего по электрохимическому механизму, является модель коррозионного гальванического элемента (микрогальванопар). Возникновение катодных и анодных участков на поверхности металла связано: с химической и геометрической неоднородностью поверхности; механическими напряжениями; неоднородностью коррозионной среды; температурным градиентом поверхности; контактом с другими металлами и многими другими факторами. Рассмотрим некоторые из этих факторов более подробно.
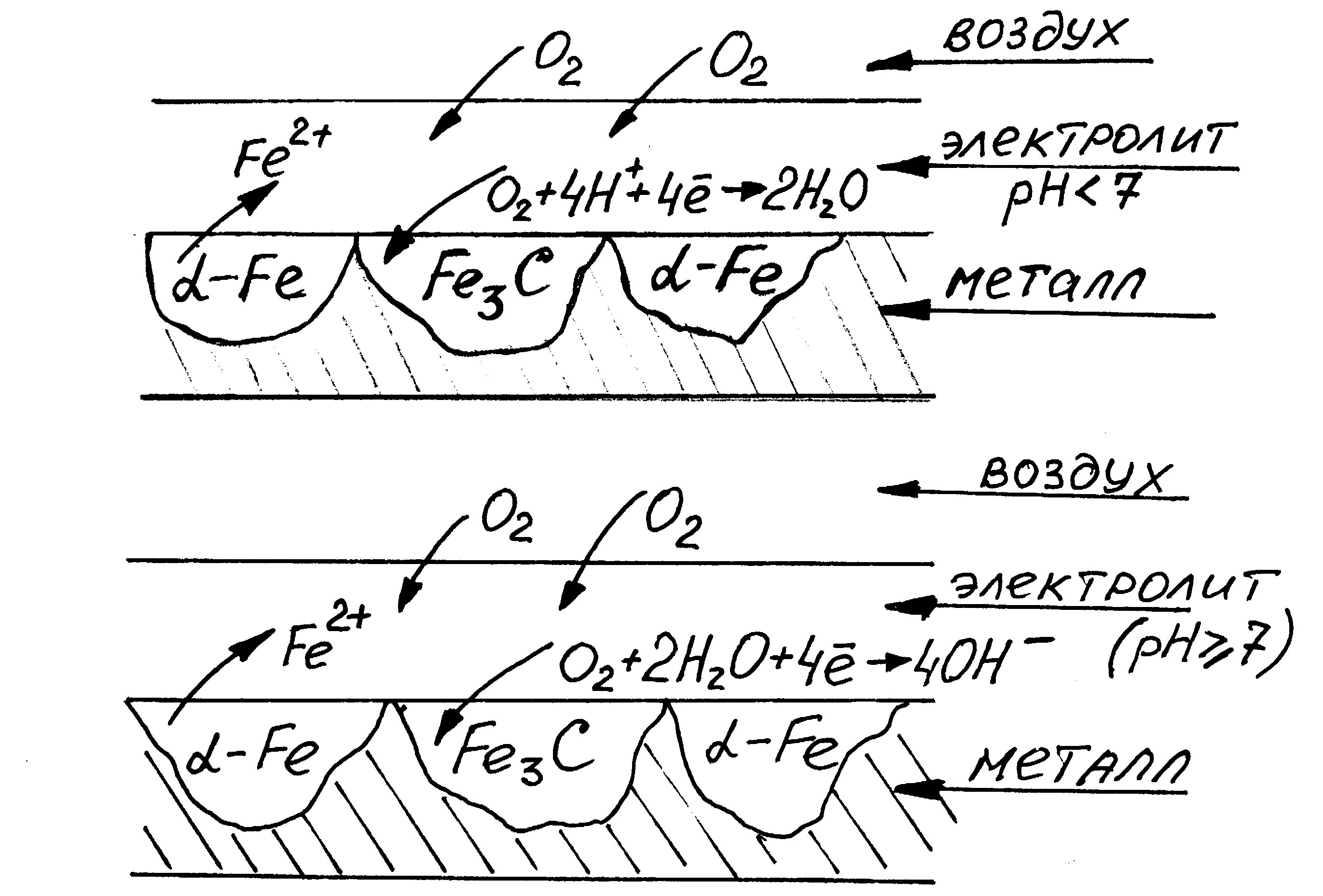
Химическая неоднородность поверхности.Ниже приведены схемы коррозии углеродистой стали для различных сред, в которых пассивными (катодными) участками являются зерна карбида железа (Fe3C).
| Коррозионные процессы: Fe - 2e = Fe2+ 2 О2 + 4Н+ + 4е = 2Н2О1 ___________________________________ 2Fe + O2 +4H+ = 2Fe2+ + 2 H2O |
| Коррозионные процессы: Fe - 2e = Fe2+ 2 О2 + 2Н2O + 4е = 4OН-1 2Fe + O2 +2H2O = 2Fe2+ + 4OH- 2Fe2+ + 4OH- = 2Fe(OH)2 |
В данном примере рассматривается работа коррозионной микрогальванопары 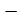 металл и его соединение. При коррозии эвтектического сплава возможен процесс
металл и его соединение. При коррозии эвтектического сплава возможен процесс
селективного вытравливания зерен одного из компонентов (более активного металла).
| Коррозионные процессы: (кислая среда) Fe - 2e = Fe2+ 2Н+ +2е = Н2 Fe + 2H+ = Fe2+ + H2 |
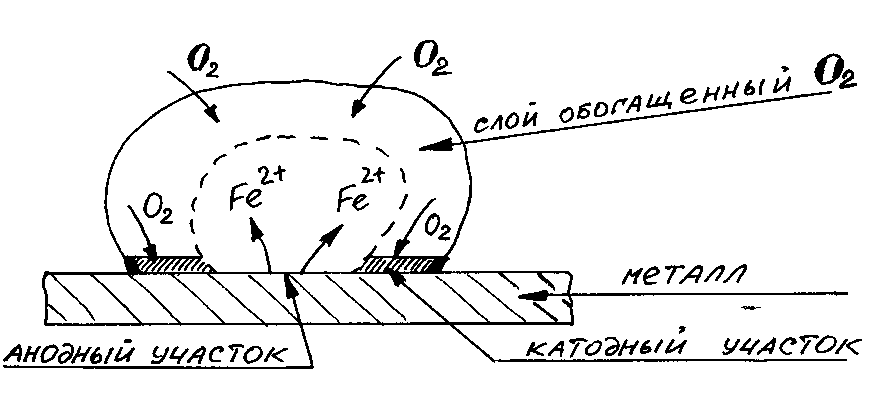
Влияние неоднородности состава коррозионной среды. Неоднородность состава среды может приводить к образованию микрогальванопар даже на поверхности одного и того же металла. Примером может служить коррозия металла под каплей воды. Так как поверхностные слои воды содержат больше растворенного кислорода, чем внутренние, поверхность металла в центре под каплей оказывается более активной (анодный участок). После высыхания капли в центре металлической пластинки появляется довольно глубокое пятно ржавчины. Такие процессы наиболее часто наблюдаются при атмосферной и почвенной коррозии. В общем случае неоднородность состава среды приводит к неравенству электродных потенциалов на различных участках поверхности металла, что и способствует образованию микрогальванопар.
Механические напряжения. Коррозионные микрогальванопары могут
возникать при действии внешних и внутренних механических напряжений (например, остаточные напряжения после сварки). Коррозия при действии внешних
и внутренних напряжений приводит к межкристаллитному растрескиванию, или так называемой «ножевой» коррозии.
Дата добавления: 2021-01-26; просмотров: 561;











