Схема электролиза с нерастворимым анодом
Электролиз водного раствора иодида натрия NaI. Схема электролизера.
(-) Cграфит | Раствор NaI | Cграфит (+)
1. В водном растворе иодида натрия присутствует три вида частиц, способных участвовать в электродных реакциях: молекулы воды Н2О, ионы Na+ и I-. Анодный графит считается инертным (нерастворимым) электродом.
2.3. Возможные анодные реакции:
(+) An: 2I- - 2 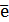 = I2 E0 = + 0,536 B (1)
= I2 E0 = + 0,536 B (1)
2 Н2О - 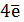 = O2 + 4H+ E0 = + 1,23 B (2)
= O2 + 4H+ E0 = + 1,23 B (2)
Возможные катодные реакции:
(-)KatNa+ + 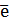 = Na0 E0 = - 2,714 B (1)
= Na0 E0 = - 2,714 B (1)
2Н2О + 2 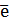 = H2 + 2OH- E0 = - 0,82 B (2)
= H2 + 2OH- E0 = - 0,82 B (2)
4.Сравнив потенциалы реакций, делаем вывод, что на аноде будет протекать реакция №1, так как ее потенциал наименьший, а на катоде - реакция №2,так как ее потенциал наибольший.
5.Сложив эти уравнения, получим суммарную реакцию электролиза
ИМУ 2I- + 2Н2О = I2 + H2 + 2OH-
МУ 2NaI + 2Н2О = I2 + H2 + 2NaOH
В результате электролиза водного раствора иодида натрия с нерастворимым графитовым анодом получают в анодном пространстве электролизера молекулярный иод, а в прикатодном пространстве - раствор гидроксида натрия и выделяющийся газообразный водород.
Следует отметить, что приведенные примеры электролиза рассмотрены в упрощенном варианте. В реальных процессах необходимо учитывать специфическое (адсорбционное) взаимодействие ионов и материала электродов.
Энергия этого взаимодействия может быть настолько велика, что некоторые анионы (An-) могут восстанавливаться на отрицательном катоде, а положительные катионы окисляться на положительном аноде. Использование термодинамических стандартных потенциалов для определения последовательности электродных реакций тоже условно, так как прохождение тока через электролизер сопровождается поляризацией электродов. Результатом поляризации является смещение электродных потенциалов у анода - в положительную сторону, а у катода - в отрицательную. Кроме того, степень смещения этих потенциалов зависит от материала электродов. Это объясняется тем, что нерастворимые электроды являются не только токоподводами, но и выполняют роль катализаторов электродных реакций. Очевидно, что каталитическая активность различных материалов по отношению к конкретной реакции является различной. Степень затрудненности электродных реакций на электродах из различных материалов оценивается параметром, называемым «перенапряжение» (h,В).
Детализация перечисленных явлений не входит в программу настоящего пособия и требует работы с дополнительной литературой.
Дата добавления: 2021-01-26; просмотров: 882;











