Задания для текущих и промежуточных контролей
Раздел I
1. В момент установления равновесия в системе
N2(г) + 3Н2(г) ↔2NH3(г)
молярные концентрации азота, водорода и аммиака соответственно равны 2,5; 1,8; и 3,6 моль/л. Вычислите константу химического равновесия и начальные молярные концентрации азота и водорода.
Ответ: 0,9; 4,3 моль/л; 7,2 моль/л.
2. Химическое равновесие в гомогенной системе
А +2В ↔ С
установилось при следующих молярных концентрациях веществ (моль/л): С(А) = 0,06; С(В) = 0,12; С(С) = 0,216. Вычислите константу равновесия и начальные молярные концентрации веществ А и В.
Ответ: 250; 0,276 моль/л; 0,552 моль/л.
3. В реакционной массе, содержащей в начальный момент времени 3 моль/л кислорода и 5 моль/л водорода, в результате химической реакции образуется вода. В состоянии равновесия молярная концентрация продукта реакции составила 4 моль/л. Определите константу равновесия реакции.
Ответ: 16.
4. Константа равновесия реакции
FeO(к) + СО(г) ↔Fe(к) + СО2(г)
при некоторой температуре равна 0,5. Найдите равновесные молярные концентрации СО и СО2, если их начальные молярные концентрации составляли соответственно 0,05 и 0,01 моль/л.
Ответ: 0,04 моль/л; 0,02 моль/л.
5. Реакция протекает согласно уравнению 2А ↔ В. Начальная молярная концентрация вещества А равна 0,2 моль/л. Константа равновесия реакции Кс = 0,5. Определите равновесные молярные концентрации веществ А и В.
Ответ: ~0,17 моль/л; ~0,015 моль/л.
6.Через некоторое время после начала гомогенной реакции
4HCl + O2 ↔ 2H2O + 2Cl2
при установившемся равновесии молярные концентрации веществ стали равными (моль/л) 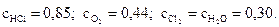
Определите начальные молярные концентрации НCl и О2.
Ответ: 1,45 моль/л; 0,59 моль/л.
7. Вычислите константу равновесия гомогенной реакции
N2 + 3H2 ↔ 2NH3,
если начальные молярные концентрации азота и водорода составляли соответственно 6 и 13 моль/л, а в момент равновесия молярная концентрация аммиака была 8 моль/л.
Ответ: 32.
8. В замкнутом сосуде протекает газофазная реакция
АВ ↔ А + В.
Определите начальную молярную концентрацию исходного вещества АВ, если известно, что константа равновесия реакции равна 0,04, а равновесная молярная концентрация вещества А составляет 0,02 моль/л.
Ответ: 0,03 моль/л.
9. Вычислите константу равновесия системы
H2 + I2 ↔ 2HI,
если реакция началась при молярных концентрациях водорода и йода, равных 1 и 0,6 моль/л соответственно, а в момент равновесия молярная концентрация HI была 1 моль/л.
Ответ: 20.
10. Протекает газофазная реакция
3А + 2В ↔ 3С.
При установившемся химическом равновесии зафиксированы следующие молярные концентрации реагирующих веществ (моль/л): С(А) = 5; С(В) = 5; С(С) = 6. Определите молярные концентрации веществ А и В в начальный момент времени. Вычислите константу равновесия гомогенной реакции.
Ответ: 11 моль/л; 9 моль/л; 0,06912.
11. При температуре 713 К константа диссоциации HI равна 0,0156. Найдите концентрации H2, I2 и HI в состоянии равновесия, если вначале было взято 2 моль HI. Вместимость реакционного сосуда равна 5 л.
Ответ: 0,04 моль/л; 0,04 моль/л; 0,32 моль/л.
12. Константа равновесия гомогенной реакции
СО2 + Н2 ↔ СО + Н2О
равна 1. Рассчитайте равновесные молярные концентрации всех веществ, если начальные молярные концентрации водорода и диоксида углерода составляли соответственно 0,6 и 0,3 моль/л.
Ответ: 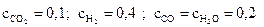 моль/л.
моль/л.
13. Начальные молярные концентрации оксида азота и хлора в газофазной реакции
2NO + Cl2 ↔ 2NOCl
равны соответственно 0,5 и 0,2 моль/л. К моменту наступления равновесия прореагировало 20 % оксида азота. Вычислите константу равновесия реакции.
Ответ: 0,42.
14. Константа равновесия гомогенной реакции
СО + Н2О ↔ СО2 + Н2
при некоторой температуре равна 1. Вычислите равновесные молярные концентрации всех веществ, если начальные молярные концентрации СО и Н2О были одинаковы и составляли 1 моль/л.
Ответ: 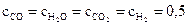 моль/л.
моль/л.
15. Начальные молярные концентрации оксида углерода (II) и паров воды равны и составили 0,03 моль/л. Вычислите равновесные молярные концентрации СО, Н2О и Н2 в гомогенной реакции СО + Н2О ↔ СО2 +Н2, если известно, что
равновесная молярная концентрация СО2 равна 0,01 моль/л.
Ответ: 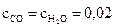 моль/л;
моль/л; 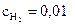 моль/л.
моль/л.
16. Определите Кс газофазной реакции
2SO2 + O2 ↔ 2SO3,
если начальные молярные концентрации веществ равны 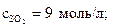
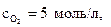 а к моменту равновесия прореагировало 80 % кислорода.
а к моменту равновесия прореагировало 80 % кислорода.
Ответ: 64.
17. Начальная молярная концентрация кислорода в гомогенной системе 3О2 ↔ 2О3 была равна 1,2 моль/л. Вычислите Кс, если к моменту установления равновесия 70 % кислорода превратилось в озон.
Ответ: 6,72.
18. Гомогенная реакция
Н2 + I2 ↔ 2HI
началась при молярных концентрациях водорода и йода 1 и 0,6 моль/л соответственно. К моменту наступления равновесия прореагировало 50 % водорода. Определите Кс.
Ответ: 20.
19. Реакция протекает по уравнению А + В ↔ 2С.
Определите равновесные концентрации реагирующих веществ, если начальные молярные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции равна 50.
Ответ: сА=0,06 моль/л; сB=0,26 моль/л; cC=0,88 моль/л.
20. Вычислите равновесные молярные концентрации веществ в гомогенной реакции CH4 + I2 ↔ CH3I + HI, если в исход-
ной смеси было 2 моль/л метана и 3 моль/л йода, а константа равновесия была равна 1.
Ответ:
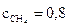 моль/л;
моль/л; 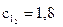 моль/л;
моль/л; 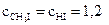 моль/л.
моль/л.
21. Начальные молярные концентрации исходных веществ SO2 и О2 в газофазной реакции 2SO2 + O2 ↔ 2SO3 были равны
1,6 и 1,2 моль/л соответственно. Найдите концентрации этих веществ в тот момент, когда образовалось 0,6 моль/л SO3.
Ответ: 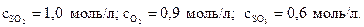
22. 4 моль оксида серы (IV) и 2 моль кислорода смешаны при давлении 3,039·105 Па. К моменту наступления равновесия в смеси осталось 20 % SO2. Определите равновесные количества SO2, O2 и образовавшегося оксида серы (VI) и давление, при котором установилось равновесие, если реакция велась в закрытом сосуде.
Ответ: 0,8 моль; 0,4 моль; 3,2 моль; 2,229•105 Па.
23. В газофазной реакции CO + Cl2 ↔ COCl2 исходные вещества взяты в эквимолярных количествах при давлении 1,013·105 Па. К моменту наступления равновесия в смеси осталось 50 % СО. Определите, каким станет давление, если реакция велась в закрытом сосуде?
Ответ: 7,6.104 Па.
24. Как изменится давление в закрытом сосуде при протекании газофазной реакции
N2 + 3H2 ↔ 2NH3,
если начальные молярные концентрации N2 и Н2 были равны 2 и 6 моль/л соответственно, а к моменту наступления равновесия доля прореагировавшего азота составила 10 %.
Ответ: давление составит 95 % от исходного.
25. При данной температуре для гомогенной реакции
А +В ↔ С +D
константа равновесия равна 1. В реакции участвовали 2 моль вещества А и 2 моль вещества В. Вычислите, какая доля вещества А (%) подверглась превращению?
Ответ: 50 %.
26. Константа равновесия гомогенной реакции
А + В ↔ С + D
равна 1. Начальные молярные концентрации веществ А и В составили 2 и 10 моль/л соответственно. Определите, сколько процентов вещества А прореагировало?
Ответ: 83,5 %.
27. Вычислите массовые доли Н2 и I2 в момент установления равновесия в реакции с образованием HI, если начальные молярные концентрации водорода и йода равны 1 моль/л, а константа равновесия при данной температуре равна 4?
Ответ: 0,0039 м.д.; 0,4961 м.д.
28. Для газофазной реакции
СОCl2 ↔ СО + Cl2
при некоторой температуре константа равновесия составляет 5, а равновесная концентрация хлора – 0,5 моль/л. Найдите равновесную концентрацию фосгена.
Ответ: 0,05 моль/л.
29. Исходные молярные концентрации СО, Н2О, СО2 и Н2 в газофазной реакции (моль/л)
СО + Н2О = СО2 + Н2
составляли 0,5, 0,6, 0,4 и 0,2 соответственно. Прореагировало 60 % Н2О. Вычислите молярные концентрации всех участвующих в реакции веществ. Ответ:
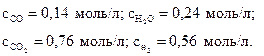
30. Равновесные молярные концентрации веществ А, В, С и D в гомогенной реакции (моль/л)
А + В ↔ С + D
составляли 18,0, 16,0, 24,0 и 12,0 соответственно. Концентрацию вещества С уменьшили на 12 моль/л, в результате чего равновесие было нарушено. Вычислите равновесные концентрации всех веществ после смещения равновесия.
Ответ:
сА=14,6 моль/л; сB=12,6 моль/л; cC=12,0 моль/л; cD=15,6 моль/л.
Раздел II
Ответы аргументировать!
1. Как повлияет на равновесие реакции
2SO2(г) + О2(г) ↔2SO3(г), DrH° = -179 кДж
охлаждение реакционной смеси?
2. Сместится ли равновесие реакции
H2(г) + I2(г) ↔HI(г)
при повышении давления?
3. В какую сторону сместится равновесие реакции
N2(г) + 3H2(г) ↔2NH3(г), DrH° = -92 кДж
при повышении температуры?
4. Как следует изменить температуру, чтобы равновесие в системе
СО2(г) + С(к) ↔2СО(г); DН > 0
сместилось влево?
5. В какую сторону сместится равновесие в системе
Na2CO3(к) + Н2О(ж) + СО2(г) ↔2NaHCO3(к)
при увеличении давления?
6. Будет ли обратимой реакция
СаСО3(к) ↔ СаО(к) + СО2(г) ,
протекающая в открытом сосуде?
7. Как следует изменить давление в системе
3Н2(г) + N2(г) ↔ 2NH3(г) ,
чтобы равновесие сместилось вправо?
8. В какую сторону сместится равновесие в системе
СН4(г) + Н2О(г) ↔ СО(г) + 3Н2(г)
при повышении давления?
9. Как повлияет повышение давления на равновесие обратимой реакции
H2SO4(ж) + 2NH3(г) ↔ (NH4)2SO4(к).
10. В системе установилось равновесие
3Fe2O3(к) + Н2(г) ↔ 2Fe3O4(к) + Н2О(г).
Сместится ли оно при повышении давления?
11. В системе 2NO(г) + Cl2(г) ↔ 2NOCl(г), DrН° = -73,6 кДж, установилось равновесие. В какую сторону оно сместится при понижении температуры?
12. В системе 2О3(г) ↔ 3О2(г); DrН° = 290 кДж установилось равновесие. В какую сторону оно сместится при повышении температуры?
13. В какую сторону в системе
SO2(г) + 2CO(г)↔ 2СO2(г) + S(к)
сместится равновесие при понижении давления?
14. В системе
2HI(г) ↔ Н2(г) + I2(г); DrН° = 52 кДж
установилось равновесие. В какую сторону оно сместится при повышении температуры?
15. В системе
СН4(г) + 2Н2S(г) ↔ СS2(ж) + 4Н2(г)
установилось равновесие. В какую сторону оно сместится при повышении давления?
16. В системе
(NH4)3PO4(к) ↔ 3NH3(г) + H3PO4(ж)
установилось равновесие. В какую сторону оно сместится при повышении давления?
17. В какую сторону сместится равновесие системы
4NH3(г) + 5O2(г) ↔ 4NO(г) + 6H2O(г)
при повышении давления?
18. В системе
2СО(г) + О2(г) ↔ 2СО2(г); DrH° =-135,2 кДж
установилось равновесие. В какую сторону оно сместится при повышении температуры?
19. В какую сторону сместится равновесие реакции
Sп.бел. ↔ Sп.сер., DrH° = -2,52 кДж,
при понижении температуры?
20. В системе
NH3(г) + H2O(ж) ↔ NH4OH(ж)
установилось равновесие. Как изменится концентрация NH4OH(ж) при уменьшении давления?
21. В какую сторону в системе 2NO(г) + O2(г) ↔ 2NO2(г сместится равновесие) при повышении давления?
22. В системе
СаН2(к) ↔ Са(к) + Н2(г)
установилось равновесие. В какую сторону оно сместится при повышении давления?
23. В системе
Cr2O3(к) + Al(к) ↔ Al2O3(к) + 2Cr(к) DrH° = -120 кДж
установилось равновесие. В какую сторону оно сместится при повышении температуры?
24. В системе
NH4Cl(к) ↔ NH3(г) + HCl(г)
установилось равновесие. В какую сторону оно сместится при повышении давления?
25. В системе
2С2Н6(г) ↔ С2Н4(г) + 3H2(г) + С2Н2(г)
установилось равновесие. В какую сторону оно сместится при понижении давления?
26. В какую сторону в системе
SO3(г) + H2O(ж) ↔ H2SO4(ж), DrH° =-88,2 кДж
сместится равновесие при повышении температуры?
27. В какую сторону в системе
4HCl(г) + O2(г) ↔ 2Cl2(г) + 2H2O(г)
сместится равновесие при повышении давления?
28. В системе
СО2(г) + Н2О(ж) ↔ Н2СО3(ж)
установилось равновесие. В какую сторону оно сместится при понижении давления?
29. В системе
Fe3O4(к) + 4H2(г) ↔ 3Fe(к) + 4H2O(г)
установилось равновесие. В какую сторону оно сместится при повышении давления?
30. В какую сторону в системе
SO2(г) + H2O(ж) ↔ H2SO3(ж)
сместится равновесие при понижении давления?
Дата добавления: 2016-10-07; просмотров: 5367;











