Квантово-механическая модель строения атома
Рабочая программа. Атом и его структурные элементы: атомное ядро (протоны, нейтроны) и электронная оболочка. Свойства структурных элементов атома. Электрон как элементарная частица. Модель атома Н. Бора. Корпускулярно - волновой дуализм электрона. Уравнение де Бройля. Принцип неопределенности Гейзенберга.
Квантово-механическое объяснение строения атома. Уравнение Шредингера. Волновая функция. Квантовые числа: главное, орбитальное, магнитное и спиновое числа, их энергетический и геометрический смысл.
Понятия: атомная орбиталь, граничная поверхность, энергетические уровни и подуровни. Квантовые ячейки. Форма атомных орбиталей, их ориентация в пространстве. Распределение электронных плотностей.
Многоэлектронные атомы. Принципы заполнения электронами атомных орбиталей: запрет Паули, принцип наименьшей энергии, правило Клечковского, правило Гунда.
До середины ХIХ века атом считался мельчайшей и неделимой частицей материи. Открытие электрона и радиоактивности доказало сложность строения атома.
Электрон был открыт в 1897 г. Масса электрона равна 9,11 10-27 г (5,9.10-4 а.е.м.), а заряд – 1,6.10-19 Кл. Заряд электрона принят за единицу отрицательного электричества.
Открытие радиоактивности в 1896 г. и последующие исследования показали, что атом состоит из положительно заряженного ядра, окруженного электронами. Радиус атома имеет порядок ~ 10-10 м, а ядра – 10-14 м. Согласно планетарной модели Резерфорда основная масса атома сосредоточена в ядре, а электроны обращаются вокруг ядра подобно планетам Солнечной системы. Атом, устроенный таким образом, должен непрерывно испускать электромагнитное излучение, и время его жизни должно составлять ~10-8с. В действительности атом устойчив и не излучает самопроизвольно.
Противоречие было разрешено датским физиком Н. Бором. Согласно постулатам модели Бора электроны в атоме движутся по определенным орбитам без потери энергии. Переход электрона с одной орбиты на другую сопровождается поглощением или испусканием энергии. В этом процессе энергия изменяется квантами:
Е1 – Е2 = hν, (5.1)
где Е1 и Е2 – энергия электрона в начальном и конечном состояниях; h – постоянная Планка (6,626.10-34 Дж.с); ν – частота излучения.
Модель Бора позволила теоретически рассчитать спектр, а также некоторые другие характеристики атома водорода, но оказалась неприменимой для многоэлектронных атомов.
Дальнейшее развитие теории строения атома стало возможным на базе принципиально новых подходов к природе движения электрона.
Корпускулярно-волновой дуализм электрона.В 1924 г. французский ученый Луи де Бройль предположил, что движение любого тела, в том числе и электрона, является волновым и удовлетворяет соотношению
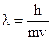 , (5.2)
, (5.2)
где λ – длина волны; h – постоянная Планка; m – масса тела; v – скорость тела.
Для обычных тел с большой массой длина волны ничтожно мала и не может быть измерена. Электроны, подобно свету, могут испытывать дифракцию и интерференции. Волновой характер движения электрона был подтвержден экспериментально.
Принцип неопределенностибыл сформулирован в 1927 г.В. Гейзенбергом: невозможно одновременно с абсолютной точностью указать положение микрочастицы и ее импульс.
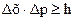 (5.3)
(5.3)
или
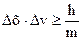 , (5.4)
, (5.4)
где Δх, Δр, Δv – точность определения координат, импульса и скорости частицы; h – постоянная Планка; m – масса частицы.
Принцип неопределенности означает, что нельзя одновременно точно определить положение и энергию электрона; можно говорить только о вероятности присутствия электрона в некотором объеме в данный момент.
В 1926 г. Э. Шредингер предложил для описания движения электрона в атоме волновое уравнение, получившее название уравнения Шредингера. Решением уравнения Шредингера является волновая функция ψ, называемая также орбиталью. Волновая функция может иметь как действительные, так и мнимые решения. Поэтому физический смысл имеет только квадрат модуля волновой функции |ψ|2, который характеризует вероятность нахождения электрона в данном объеме пространства.Термином орбитальобозначают также область пространства, в которой наиболее вероятно нахождение электрона. Орбиталь может быть представлена, в частности, с помощью так называемых граничных поверхностей, т.е. пространственных фигур, внутри которых вероятность нахождения электрона составляет 95 %.
Решение уравнения Шредингера определяется набором четырех чисел, получивших название квантовых чисел.
Главное квантовое число n характеризует энергию орбитали. Главное квантовое число принимает значения 1, 2, 3, 4, 5, 6, 7…∞, обозначаемые также буквами K, L, M, N , O, P, Q … Чем больше n, тем выше энергия орбитали. Переходы электронов с одной орбитали на другую сопровождаются излучением или поглощением квантов энергии.
Главное квантовое число характеризует также удаленность максимума электронной плотности от ядра. Чем больше n, тем больше объем орбитали. Совокупность электронов с одинаковым значением n называют энергетическим уровнем или оболочкой, слоем, например К-уровень (К-оболочка, К-слой).
Орбитальное (побочное, азимутальное) квантовое число lпринимает значения от 0 до n-1 и характеризует форму граничной поверхности атомной орбитали. Обычно вместо численных значений используют буквенные обозначения: 0-s; 1-p; 2-d; 3-f и т.д. Совокупность электронов, имеющих одинаковые значения l и n, называют энергетическим подуровнем(подоболочкой), например 1s-подуровень (n=1; l=0); 2p-подуровень (n=2; l=1) и т.д.
Граничная поверхность s-орбиталей имеет форму сферы (рис. 5.1,а), р-орбиталей – гантели (рис. 5.1,b–d). Граничные поверхности d-орбиталей показаны на рис. 5.1,e–i. Форма граничных поверхностей f-орбиталей сложнее, чем d-орбиталей.
Орбитальное квантовое число характеризует также энергию электронов подуровня в пределах данного энергетического уровня.
Энергия подуровней возрастает в ряду s, p, d, f (Es<Ep<Ed<Ef).
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве и может принимать целочисленные значения от +l до –l, включая 0. Например, для d-подуровня (l=2) магнитное квантовое числа может иметь значения -2, -1, 0, 1, 2. Таким образом, d-орбиталь может иметь пять ориентаций в пространстве (рис. 5.1,e–i). Одновременно это означает, что d-подуровень содержит пять орбиталей, s-подуровень – одну (рис. 5.1,a), p-подуровень – три (рис. 5.1,b–d), а f-подуровень – семь орбиталей.
Атомной орбиталью называют также волновую функцию, характеризуемую определенным набором трех квантовых чисел ( 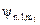 ).
).
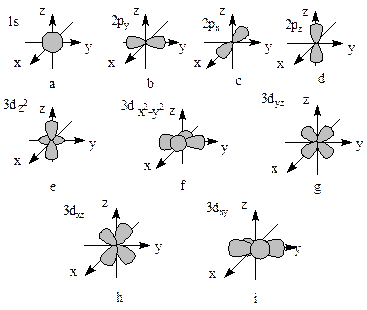
Рис. 5.1. Формы граничных поверхностей атомных орбиталей: a–1s; b–2py; c–2px; d–2pz; e–3dz2; f–3dx2-y2; g–3dxy; h–3dxz; i–3dxy. 
Спиновое квантовое число msхарактеризует собственное вращение электрона вокруг своей оси и может принимать два значения: +1/2 и -1/2.
Таким образом, состояние электрона в атоме полностью характеризуется с помощью четырех квантовых чисел: n, l, ml и ms.
Строение многоэлектронных атомов.Следующие принципы (правила) определяют заполнение электронами энергетических уровней и подуровней:
1) принцип исключения Паули (запрет Паули);
2) принцип наименьшей энергии;
3) правило Клечковского;
4) правило Гунда.
Дата добавления: 2016-10-07; просмотров: 7885;











