Моль. Молярная масса. Закон Авогадро
Атом, молекула. Элемент, простое вещество, соединение
Основная идея химии – все вещества состоят из атомов. Атом – простейшая частица вещества, не делимая химическими методами.Атом состоит из ядра и электронов. Основная химическая характеристика атома – заряд его ядра. Атомы, имеющие одинаковый заряд ядра, называют химическим элементом.Атом сохраняет все химические свойства элемента.Известные к настоящему времени химические элементы сведены в периодическую систему элементов Д.И. Менделеева (ПСЭМ). Каждый элемент обозначается латинским символом и имеет русское и латинское название. В табл. 1.1 приведены русские названия, символы и их произношение при чтении химических формул ряда наиболее часто встречающихся элементов.
Таблица 1.1. Названия некоторых элементов, их символы и произношение символов в формулах
| Элемент | Элемент | ||||
| Русское название | Сим- вол | Произношение в формулах | Русское название | Сим- вол | Произноше- ние в фор-мулах |
| Водород | Н | аш | Хлор | Cl | Хлор |
| Углерод | С | цэ | Калий | K | Калий |
| Азот | N | эн | Кальций | Ca | Кальций |
| Кислород | O | о | Хром | Cr | Хром |
| Фтор | F | фтор | Марганец | Mn | Марганец |
| Натрий | Na | натрий | Железо | Fe | Феррум |
| Магний | Mg | магний | Медь | Cu | Купрум |
| Алюмний | Al | алюминий | Цинк | Zn | Цинк |
| Кремний | Si | силициум | Бром | Br | Бром |
| Фосфор | P | пэ | Серебро | Ag | Аргентум |
| Сера | S | эс | Свинец | Pb | Плюмбум |
Атомы могут соединяться между собой, образуя молекулы. Молекула – наименьшая частица вещества, обладающая его химическими свойствами. Вещества делятся на простые и сложные соединения. Простые вещества состоят из атомов одного элемента, а сложные соединения – из атомов различных элементов. Элемент может образовывать несколько простых веществ, например: элемент кислород образует простые вещества – кислород, состоящий из молекул О2 (читается – о два), и озон, состоящий из молекул О3 (читается – о три). Сложное соединение содержит как минимум атомы двух разных элементов, например: углекислый газ, или оксид углерода (IV), состоит из молекул СО2 (читается – цэ о два), образованных одним атомом углерода и двумя атомами кислорода.
Моль. Молярная масса. Закон Авогадро
В качестве единицы количества вещества в химии используют моль. Моль – количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов и др.), сколько содержится атомов в 0,012 кг изотопа углерода 12С.Это число точно определено, составляет 6,02.1023 моль-1 и носит название постоянная Авогадро.Обозначается количество вещества символом nB; например, nCaO= 2 моль, т.е. количество вещества оксида кальция равно 2 моль, т.е. содержит 2• 6,02.1023=12,04.1023 формульных единиц СаО.
Массу одного моля вещества В называют молярной массой (обозначение МВ). Единицами измерения молярной массы являются г/моль и кг/моль.
Вещество может быть также охарактеризовано относительной молекулярной массой, равной массе молекулы или иной структурной единицы вещества, отнесенной к 1/12 массы одного атома изотопа углерода 12С (обозначение Mr(B)). Относительная молекулярная масса является величиной безразмерной. Относительные молекулярные массы элементов, называемые обычно относительными атомными массами (Аr(B)), приведены в ПСЭМ. Относительные атомные массы наиболее употребительных элементов необходимо запомнить (табл. 1.2).
Молярная масса вещества В (символ MB , единица – кг/моль) – это масса вещества В (mB), деленная на количество вещества nB,или это масса 1 моль вещества (6,02.1023 формульных единиц вещества (атомов, молекул, ионов, электронов и т.д.)). Молярная масса вещества (МВ) численно равна относительной молекулярной массе, например: относительная молекулярная масса натрия Mr(Na)=22,98977, а молярная масса натрия равна МNa=22,98977 г/моль. Относительные атомные массы элементов используют для вычисления молярных масс соединений.
Таблица 1.2. Округленные значения относительных атомных масс некоторых элементов
| Элемент | Элемент | ||||
| Русское название | Сим- вол | Относительная атомная масса | Русское название | Сим- вол | Относительная атомная масса |
| Водород | Н | Фосфор | P | ||
| Углерод | С | Сера | S | ||
| Азот | N | Хлор | Cl | 35,5 | |
| Кислород | O | Калий | K | ||
| Натрий | Na | Кальций | Ca | ||
| Магний | Mg | Железо | Fe | ||
| Алюмний | Al | Медь | Cu | ||
| Кремний | Si | Цинк | Zn |
Пример 1.1. Найти молярную массу серной кислоты (H2SO4).
Решение. Молярная масса серной кислоты численно равна сумме двух относительных атомных масс водорода, одной относительной атомной массы серы и четырех относительных атомных масс кислорода и измеряется в граммах на моль (г/моль):
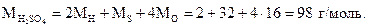
Количество вещества равно отношению массы вещества, выраженной в граммах или килограммах, к молярной массе вещества:
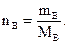 (1.1)
(1.1)
Пример 1.2. Найти количество вещества серной кислоты, если масса серной кислоты составляет 500 г.
Решение.
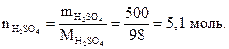
Согласно закону Авогадро в равных объемах любых газов при одинаковых давлении и температуре содержится одинаковое число молекул.Из закона Авогадро следует, что при температуре 273,15 К (0 оС) и давлении 101325 Па (нормальные условия, н.у.) 1 моль любого газа занимает объем 22,4 дм3 (л). Эта величина носит название молярный объем (VB).Объем газа, находящегося при произвольных условиях, может быть приведен к нормальным условиям с использованием формулы Менделеева–Клапейрона
 (1.2)
(1.2)
где р – давление газа; V – объем газа; mB – масса газа; МВ – молярная масса газа; Т – температура в градусах термодинамической шкалы Кельвина (К); R – универсальная газовая постоянная, равная 8,314 Дж/(моль•К), или (л•кПа)/(моль•К) в СИ, или 0,08206 (л•атм)/(моль•К), если давление выражено в атмосферах, или 62,36 (л•мм рт. ст.)/(моль•К), если давление выражено в мм ртутного столба.
При решении задач возможно использование округлённых значений температуры 273 К и давления 105 Па, соответствующих нормальным условиям, а также значения универсальной газовой постоянной 8,3Дж/(моль•К),
Пример 1.3. Найти количество вещества углекислого газа, если его объем при нормальных условиях составляет 5 дм3.
Решение. Составим пропорцию:
1 моль газа занимает объем 22,4 л,
х моль газа занимает объем 5 л.
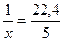 ;
; 

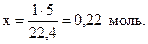
Постоянная Авогадро может быть использована для нахождения числа формульных единиц вещества*, числа атомов и т.п.
Пример 1.4. Найти число формульных единиц серной кислоты, число атомов водорода, серы и кислорода, содержащихся в 1000 г H2SO4.
Решение. Найдем количество вещества серной кислоты, используя формулу (1.1):

Составим пропорцию:
1 моль кислоты содержит 6,02.1023 формульных единиц H2SO4,
10,2 моль - “ - - “- х - “- - “- .
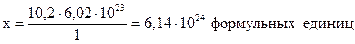 H2SO4.
H2SO4.

* Термин «формульная единица» может быть использован в тех случаях, когда термин «молекула» не соответствует реальным структурным единицам вещества. Так, в кристаллическом хлориде натрия невозможно выделить отдельные молекулы NaCl. Поэтому вместо термина «молекула NaCl» правильнее использовать термин «формульная единица NaCl» как отражающий состав соединения. Это применимо и к серной кислоте.
Одна формульная единица серной кислоты содержит 2 атома водорода, следовательно, 1000 г, или 10,2 моль, серной кислоты содержат 2•6,14.1024=1,228•1025 атомов водорода. Соответственно число атомов серы и кислорода составит 1•6,14•1024=6,14.1024 атомов серы и 4•6,14•1024=2,456•1025 атомов кислорода.
Химические формулы
Химические формулы выражают количественный и качественный состав соединения и одновременно обозначают массу, соответствующую 1 моль вещества. Например, формула азотной кислоты HNO3 означает: 1) это вещество образовано 1 атомом водорода, 1 атомом азота и 3 атомами кислорода или одним ионом водорода (Н+) и одним нитрат-ионом ( 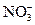 ); 2) на 1 массовую часть водорода в азотной кислоте приходится 14 массовых частей азота и 48 массовых частей кислорода; 3) масса 1 моль азотной кислоты равна 63г; 4) количество вещества азотной кислоты равно 1 моль; 5) 6,02•1023 формульных единиц азотной кислоты содержится в 1 моль этого вещества. Химические формулы используются для разнообразных расчётов.
); 2) на 1 массовую часть водорода в азотной кислоте приходится 14 массовых частей азота и 48 массовых частей кислорода; 3) масса 1 моль азотной кислоты равна 63г; 4) количество вещества азотной кислоты равно 1 моль; 5) 6,02•1023 формульных единиц азотной кислоты содержится в 1 моль этого вещества. Химические формулы используются для разнообразных расчётов.
Пример 1.5. Найти процентное содержание кальция, водорода и кислорода в гидроксиде кальция Са(OН)2.
Решение. Найдем молярную массу гидроксида кальция. Для этого в таблице ПСЭМ найдем относительные атомные массы кальция, кислорода и водорода и подставим их в формулу:
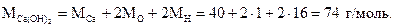 Можно также воспользоваться более удобной формулой:
Можно также воспользоваться более удобной формулой:

Для нахождения процентного содержания кальция составим пропорцию:
74 г Са(OН)2 содержат 40 г кальция,
100 г - “ - - “ - х г - “ – .
Следовательно, процентное содержание кальция в Са(OН)2 составит:

Аналогично находим процентное содержание водорода и кислорода:
74 г Са(OН)2 содержат 2 г водорода,
100 г - “ - - “ - х г - “ – ,
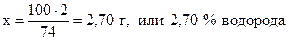 ;
;
74 г Са(OН)2 содержат 32 г кислорода,
100 г - “ - - “ - х г - “ – ,
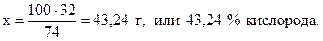
Проверим правильность вычислений. Суммарное содержание всех трех элементов в гидроксиде кальция составляет:
54,05+2,70+43,24=99,99 %.
Отклонение полученной величины от 100 % на 0,01% связано с округлением результатов.
Пример 1.6. Найти массу одной формульной единицы (молекулы) хлорида натрия (поваренной соли).
Решение.
1 моль NaCl содержит 6,02•1023 формульных единиц (молекул). Молярная масса хлорида натрия составляет
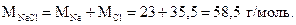
Составим пропорцию:
масса 6,02•1023 молекул NaCl составляет 58,5 г,
масса 1 - “ - - “ - - “ - - “ - х г,

Пример 1.7.Найти простейшую формулу соединения, содержащего (по массе) 40 % углерода, 6,7 % водорода, 53,3 % кислорода, если плотность его паров по водороду составляет 15.
Решение. Обозначим числа атомов углерода, водорода и кислорода в простейшей формуле соединения через x, y и z. Молекулярные массы этих элементов равны 12, 1 и 16. Поэтому массы углерода, водорода и кислорода в составе соединения относятся как 12x:1y:16z. По условиям задачи это отношение равно 40:6,7:53,3. Следовательно,
12x:y:16z=40:6,7:53,3,
откуда 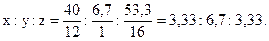
Чтобы выразить полученное отношение целыми числами, разделим его члены на меньшее из них:
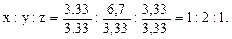
Таким образом, простейшая формула соединения – СН2О. Относительная молекулярная масса соединения Мr=12+2+16=30. Относительная молекулярная масса, определенная по относительной плотности, составляет
М = 2.15=30.
Следовательно, простейшая и истинная формулы соединения совпадают.
Отметим, что простейшие и истинные формулы веществ совпадают далеко не всегда. Например, простейшая формула глюкозы имеет вид СН2О, а истинная – С6Н12О6. Следовательно, простейшая формула отражает только соотношение числа атомов элементов в молекуле (формульной единице), но не число этих атомов в молекуле. Для определения истинной формулы помимо простейшей формулы обязательно определение молярной массы соединения.
Дата добавления: 2016-10-07; просмотров: 4028;











