Основные классы неорганических веществ
Металлы. Неметаллы.Все элементы ПСЭМ делятся на металлы и неметаллы. К металлам относятся элементы главных подгрупп, расположенные в ПСЭМ ниже диагонали: бор (B), кремний (Si), мышьяк (As), теллур (Te), астат (At), все элементы побочных подгрупп, включая лантаниды и актиниды. Элементы, находящиеся в ПСЭМ выше этой диагонали, включая B, Si, Te, At, являются неметаллами. Элементы германий, мышьяк и сурьма относятся к так называемым полуметаллам. Эти элементы обладают свойствами как металлов, так и неметаллов.
Все металлы, за исключением ртути, при стандартных условиях (298,15 К, 101,325 кПа) являются твердыми блестящими веществами, хорошо проводят электрический ток. Неметаллы могут быть газообразными (азот, кислород), жидкими (бром) и твердыми (углерод, фосфор).
В химических реакциях металлы обычно отдают электроны, т.е. проявляют положительные степени окисления. Между собой металлы, как правило, образуют не химические соединения определенного состава, а соединения переменного состава, называемые сплавами. Для металлов характерны химические реакции с неметаллами.
Неметаллы в химических реакциях обычно принимают электроны и проявляют отрицательные степени окисления. Неметаллы могут реагировать как с металлами, так и между собой.
Бинарные соединения (оксиды, галогениды, сульфиды). Бинарными соединениями называют соединения, образованные двумя элементами. Наиболее распространёнными и важными являются соединения различных элементов с кислородом (оксиды), элементами 7-й группы главной подгруппы, называемыми общим термином галогены,– фтором, хлором, бромом, иодом (галогениды) и серой (сульфиды).
Почти все элементы ПСЭМобразуют соединения с кислородом, большинство при непосредственном взаимодействии элементов. Название соединения элемента с кислородом образуют путем прибавления названия элемента в родительном падеже к слову оксид. Например, СаО – оксид кальция. Если элемент образует несколько оксидов, то после названия добавляют степень окисления элемента в круглых скобках, например FeO – оксид железа (II), Fe2O3 – оксид железа (III). Приведем несколько примеров реакций образования оксидов:
2Ca + O2 =2CaO – оксид кальция;
2Mg + O2 =2MgO – оксид магния;
4Al + 3O2 = 2Al2O3 – оксид алюминия;
Si + O2 = SiO2 – оксид кремния;
S + O2 = SO2 – оксид серы (IV).
Реакции элементов с галогенами сопровождаются образованием галогенидов:
H2 + Cl2 = 2HCl – хлорид водорода (хлористый водород);
2Na + Cl2 = 2NaCl – хлорид натрия (поваренная соль);
Сa + F2 = CaF2 – фторид кальция;
2Al + 3I2 = 2AlI3 – иодид алюминия.
Водные растворы соединений галогенов с водородом являются кислотами, например HF – плавиковая кислота, HCl – соляная, или хлористоводородная, кислота.
Многие элементы могут вступать в реакции с серой, образуя сульфиды:
2Na + S = Na2S – сульфид натрия;
Mg + S =MgS – сульфид магния.
Водный раствор соединения серы с водородом (H2S) проявляет кислотные свойства и носит название сероводородной кислоты.
Химические свойства оксидов.Оксиды металлов 1-й и 2-й групп главных подгрупп ПСЭМ могут взаимодействовать с водой, образуя гидроксидыили основания:
Na2O + H2 O = 2NaOH – гидроксид натрия (едкий натр);
СаO + H2 O = Ca(OH)2 – гидроксид кальция (гашёная известь).
Оксиды, способные образовывать прямо или косвенно основания, называют основными оксидами.
Оксиды многих неметаллов при взаимодействии с водой образуют кислоты:
СO2 + H2 O = H2СO3 – угольная кислота;
SO3 + H2 O = H2SO4 – серная кислота.
Оксиды, способные образовывать прямо или косвенно кислоты, называют кислотными оксидами.
Основные оксиды способны взаимодействовать с кислотными оксидами с образованием солей:
СаO + СO2 = СаСO3 – карбонат кальция, соль угольной кислоты;
MgO + SO3 = MgSO4 – сульфат магния, соль серной кислоты.
Ряд оксидов, называемых амфотерными,способен реагировать и с кислотными и основными оксидами. К ним относятся, например, оксиды бериллия, алюминия, цинка.
ZnO + СаO = СaZnO2 – цинкат кальция;
ZnO + SO3 = ZnSO4 – сульфат цинка.
Многие оксиды непосредственно с водой не взаимодействуют, например SiO2, MgO и др. Тем не менее косвенными реакциями могут быть получены соответствующие основания (например, Mg(OH)2 – гидроксид магния) или кислоты (H2SiO3 – кремниевая кислота). По этой причине оксид магния относят к основным оксидам, а оксид кремния – к кислотным.
Гидроксиды (кислоты, основания, амфотерные гидроксиды).Основания и содержащие кислород кислоты имеют в своём составе гидроксидную группу (ОН) и называются гидроксидами. Например:
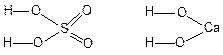
Различия в химических свойствах гидроксидов определяются различиями свойств атомов, с которыми связаны гидроксидные группировки ОН. Гидроксиды, образованные атомами элементов со степенью окисления, равной 1, почти всегда являются основаниями. Большинство гидроксидов, образованных атомами элементов со степенью окисления 2, также относятся к основаниям. Гидроксиды, образованные атомами элементов со степенью окисления от 4 до 8, относятся к кислотам. Если же степень окисления атомов равна 3, то их гидроксиды обычно являются амфотерными. Амфотерными являются также некоторые из гидроксидов элементов со степенями окисления 2 и 4.
Для кислот характерны следующие основные химические свойства:
· взаимодействие с активными металлами с образованием солей и выделением водорода:
H2SO4 + Mg = MgSO4 + H2;
· взаимодействие с основаниями и амфотерными гидроксидами (реакция нейтрализации), в результате чего образуются соли и вода:
HNO3 + NaOH = NaNO3 + H2O;
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O;
· взаимодействие с основными и амфотерными оксидами с образованием солей и воды:
2HCl + MgO = MgCl2 + H2O;
2HCl + ZnO = ZnCl2 + H2O.
Наиболее типичными реакциями оснований являются:
· взаимодействие с кислотами и амфотерными гидроксидами с образованием солей и воды (реакция нейтрализации):
Са(OH)2 + H2SO4 = СаSO4 + H2O;
Са(OH)2 + Zn(OH)2 = СаZnO2 + 2H2O;
· взаимодействие с кислотными и амфотерными оксидами с образованием солей и воды:
2KOH + CO2 = K2CO3 + H2O;
2NaOH + Al2O3 = 2NaAlO2 + H2O.
Амфотерные гидроксиды ведут себя в реакциях с кислотами как основания, а в реакциях с основаниями как кислоты.
В табл. 1.6 приведены формулы и названия важнейших кислот и их солей и ряда оснований.
Таблица 1.6. Формулы и названия некоторых оснований, кислот и их солей
| Формула | Химическое название | Синоним (тривиальное название) | Химическое название солей |
| H2SO4 | Серная кислота | Сульфаты | |
| HNO3 | Азотная кислота | Нитраты | |
| HCl | Хлористоводородная кислота | Соляная кислота | Хлориды |
| H2CO3 | Угольная кислота | Карбонаты | |
| СН3СООН | Уксусная кислота | Ацетаты | |
| NaOH | Гидроксид натрия | Едкий натр, каустическая сода | |
| KOH | Гидроксид калия | Едкое кали | |
| Ca(OH)2 | Гидроксид кальция | Гашеная известь | |
| NH4OH | Гидроксид аммония | Водный ам-миак, наша-тырный спирт |
Соли. Соединения, содержащие в своём составе атомы металлов и кислотные остатки, называются солями.
Соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металла. При полном замещении всех способных к замещению атомов водорода в молекуле кислоты образуются средние соли, например Na2SO4 – сульфат натрия. При частичном замещении атомов водорода в молекулах многоосновных кислот образуются кислые соли, например NaHСO3 – гидрокарбонат натрия (устаревшее название – бикарбонат натрия).
Соли можно также рассматривать как продукты замещения гидроксидных групп в молекуле основания на кислотные остатки. При полном замещении всех гидроксидных групп образуются средние соли, например СаCl2. При частичном замещении образуются основные соли, например Ca(OH)Cl – гидроксохлорид кальция. Очевидно, что основные соли не могут быть образованы гидроксидами одновалентных металлов.
Приведем некоторые химические свойства солей.
· Взаимодействие с растворимыми в воде основаниями (NaOH, КOH, Са(OH)2); реакции протекают в том случае, если образующийся гидроксид плохо растворим в воде:
Zn(NO3)2 + 2NaOH =2 NaNO3 + Zn(OH)2 ↓.
Стрелка означает, что гидроксид цинка выпадает в осадок.
· Взаимодействие с кислотами; реакция протекает, если продукт реакции является летучим:
Na2CO3 + H2SO4 = Na2SO4 + H2CO3.
Угольная кислота неустойчива, легко разлагается на воду и летучий углекислый газ. Иначе реакция может быть записана так:
Na2CO3 + H2SO4 = Na2SO4 + H2О + CO2↑.
Стрелка означает, что углекислый газ улетучивается.
· Соли взаимодействуют друг с другом, если один из продуктов реакции плохо растворим в воде:
Na2CO3 + СаCl2 = СаCO3↓ + 2NaCl.
Дата добавления: 2016-10-07; просмотров: 2098;











