Окислительно-восстановительные процессы
Степень окисления элементов в ходе химических реакций может не изменяться, и такие реакции называют обменными.Примерами обменных реакций могут быть реакции взаимодействия кислот и оснований (реакции нейтрализации).
В то же время очень многие реакции сопровождаются изменением степеней окисления участвующих в них элементов, например:
2Mg + O2 = 2MgO.
Степень окисления магния и кислорода до реакции равна нулю. В ходе реакции магний как типичный металл отдаёт 2 электрона и приобретает заряд 2+ , а кислород как типичный неметалл принимает 2 электрона и приобретает заряд 2-. Эти процессы можно записать в виде схем:
Mg - 2e → Mg2+,
O + 2e → O2-.
Процесс потери электронов называют окислением, а вещество, отдающее электроны, является восстановителем;магний является восстановителем, он окисляется.Процесс принятия электронов называют восстановлением, а вещество, принимающее электроны, является окислителем;атом кислорода является окислителем, он восстанавливается.
Реакции, сопровождающиеся передачей электронов от одного вещества к другому и изменением степеней окисления участников реакции, носят название окислительно-восстановительных реакций.
Процессы окисления и восстановления протекают всегда одновременно; окисление одного вещества всегда связано с восстановлением другого.
Для составления уравнений окислительно-восстановительных реакций необходимо уметь определятьстепени окисления элементов в соединениях. Под степенью окисления, или окислительным числом, понимают условный заряд, который приобрел бы атом, если бы все общие электроны, образующие химическую связь, целиком принадлежали одному из атомов,обычно атому неметалла.
Степень окисления элементов (СО) определяют на основе следующих правил:
1) СО простых веществ равна нулю;
2) для металлов первой группы главной подгруппы (Li, Na, K) СО+1;
3) для металлов второй группы главной подгруппы (Be, Mg, Ca) СО+2;
4) для кислорода СО -2;
5) для водорода СО +1;
6) для галогенов в бинарных соединениях с металлами СО -1;
7) в соединениях отрицательная СО относится обычно к неметаллам, а положительная – к металлам;
8) алгебраическая сумма положительных и отрицательных СО в нейтральной молекуле равна нулю, а в ионе – заряду иона.
Пример 1.12.Определить СО фосфора в фосфате натрия (Na3PO4).
Решение. Обозначим СО фосфора через Х. Степень окисления иона натрия (+1), следовательно, сумма СО трех ионов натрия составляет 3.(+1)=+3. Степень окисления кислорода составляет (-2), следовательно, сумма СО четырех атомов кислорода составляет 4.(-2)=-8. Сумма СО всех атомов равна нулю: (+3)+(-8)+Х=0. Таким образом, СО фосфора Х=+5.
Окислители и восстановители.В соответствии с окислительно-восстановительными свойствами все вещества делят на три группы.
· Окислители.Окислителями являются вещества, способные только принимать электроны и неспособные к их отдаче. К окислителям относятся:
а) катионы металлов в высших степенях окисления, например Sn4+, Pb4+;
б) анионы, содержащие элементы в высших степенях окисления, например:
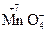 – перманганат-ион;
– перманганат-ион; 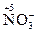 – нитрат-ион;
– нитрат-ион;
 – хромат-ион;
– хромат-ион; 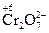 – дихромат-ион.
– дихромат-ион.
в) из простых веществ только фтор F2.
· Восстановители. Восстановителями являются вещества, способные только отдавать электроны и неспособные их принимать. К восстановителям относятся:
а) металлы 1-й и 2-й групп главных подгрупп;
б) соединения, содержащие элементы в наименьшей степени окисления, например 
· Окислители-восстановители.К ним относятся вещества, способные в зависимости от условий принимать или отдавать электроны. К этой группе относятся почти все неметаллы (N2; Cl2; C; O2; Si и др.), соединения, содержащие катионы металлов в промежуточных степенях окисления (Fe2+; Pb2+; Cr3+ и др)., или анионы, в составе которых имеются элементы в промежуточных степенях окисления: 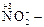 нитрит-ион;
нитрит-ион;  сульфит-ион,
сульфит-ион,  и многие другие соединения, содержащие элементы в промежуточных степенях окисления: СО; SO2; NO2 и т.д.
и многие другие соединения, содержащие элементы в промежуточных степенях окисления: СО; SO2; NO2 и т.д.
Дата добавления: 2016-10-07; просмотров: 2725;











