Анемии от нарушения эритропоэза. Железодефицитные анемии
К данной группе относят все виды малокровия, при которых снижение объёма эритрона и концентрации гемоглобина вызвано недостаточностью образования эритроцитов и/или синтеза гемоглобина.
Дизэритропоэтические анемии — широкое понятие, включающее как малокровие, вызванное нарушениями пролиферации и ускоренной гибелью эритроидных клеток в костном мозге, так и малокровие, связанное со сниженным синтезом гемоглобина в клетках, пролиферирующих с достаточной скоростью.
Нарушение эритропоэза может быть результатом мутагенных или цитотоксических воздействий на костный мозг (см. ниже — «Апластические анемии»); Но многие из анемий дизэритропоэти- ческой группы связаны с дефицитом незаменимых факторов питания, необходимых для адекватного эритропоэза.
По сравнительной пораженности населения железо дефицитная анемия далеко опережает все другие виды малокровия и любые метаболические заболевания вообще. В силу большого практического значения железодефицитных анемий (ЖДА) ниже, в первую очередь, обсуждается патофизиология метаболизма железа и связанных с ним форм малокровия.
Железодефицитные анемии. Патохимические аспекты обмена железа, как и общая характеристик железодефицитных и железоизбыточных метаболических расстройств, уже обсуждались детально в т.2 данного издания в главе «Патофизиология обмена микроэлементов».
Для ознакомления с общеметаболическими аспектами нарушений обмена железа отсылаем читателя к данному источнику. Ниже представлены гематологические аспекты патофизиологии обмена железа. Остальной материал, связанный с патохимией обмена железа повторён в данном томе лишь частично и вкратце.
Дефицит железа и его крайняя степень, выражающаяся в железодефицитной анемии, чрезвычайно распространены и в среднем поражают не менее 12% населения и около 20% женщин. В беднейших странах этот показатель превышает 50% населения. В группах высокого риска по железодефициту (беременные, кормящие, новорождённые, недоношенные, подростки, престарелые, лица с геморрагическими заболеваниями, малоимущие слои населения, строгие вегетарианцы) частота дефицита железа повсеместно еще выше — например, среди беременных - около 50%.
В различных странах, в том числе характеризующихся высоким жизненным уровнем населения, снижение запасов железа было найдено при скрининг-обследованиях у 25% обследованных детей, 30% подростков, но лишь у 3% мужчин.
Запасы железа у мужчин значительно превышают таковые у женщин. Превышение достигает 100, а по другим данным, даже 200%. Отсюда ясно, почему железодефицит поражает, намного чаще, женщин, в то время как гемохроматоз, связанный с избытком железа, наблюдается, в основном у мужчин.
В связи с половыми различиями в обмене железа, следует отметить, что менструальные кровотечения у женщин легко могут стать причиной железодефицита. Показано, что средняя кровопотеря в ходе менструации составляет около 40 мл/цикл, что эквивалентно утрате около 15 мг железа за месяц. Известно, что 10% женщин теряют 80 мл/ цикл, что эквивалентно потере 30 мг железа. Поскольку абсорбция 1 мг железа/день требует наличия 10-20 мг железа в пище, понятно почему при среднем содержании железа в диете около 10 мг/день баланс железа у обильно менструирующих женщин весьма неустойчив.
Железо присутствует в пищевых продуктах в различных формах: в окисной (Fe3+) и закисной (Fe2+). Наиболее хорошо усваивается и быстрейшим, прямым способом всасывается окисное железо в составе гемина из животных продуктов. Таким образом, диеты, богатые мясом, сводят вероятность экзогенного железодефицита к минимуму.
В растительных, особенно, зерновых продуктах, до 60% железа находится в трудноусвояемой форме, связанной с фитиновой кислотой. Окисное негеминовое ферри-железо, в том числе, из состава минеральных компонентов диеты, должно освободиться из органических комплексов и превратиться в закисное ферро-железо, чтобы всосаться в клетки слизистой кишечника.
Основные этапы метаболизма железа отражает схема на рис. 16. Потребность взрослого человека в железе — 5 мг на 1000 ккал или 15 мг/ сутки. Но только 5-10% пищевого железа всасывается, то есть 1-1,5 мг. При дефиците железа всасывание растёт и, например, у беременных достигает 4 мг/день. Любопытно и практически важно, что у грудных детей при железодефиците усиления всасывания железа почти не происходит.
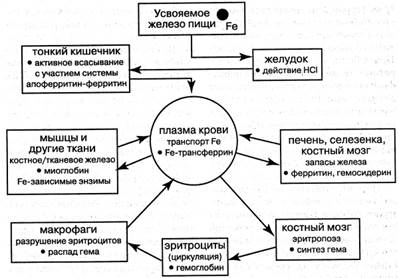
Рис. 16. Основные этапы метаболизма железа
Соляная кислота желудка и витамин С способствуют переходу пищевого железа во всасываемую, некомплексную ферро-форму. Ускорение транспорта химуса, гиповитаминоз С, избыток цинка и меди, ахилия и агастрическое состояние, энтериты - повышают риск железодефицита.
Всасывание железа, в основном, идёт в верхней части тонкого кишечника. Желудок, подвздошная и толстая кишки участвуют в этом процессе в малой степени.
Железо гемина свободно проходит через клетки интестинальной слизистой, внутри гем деградирует под действием специальных ферментов, а железо присоединяется к пулу внутриклеточного белка ферритина.
Свободное железо в закисной форме связывается с мембранным и, возможно, секретируемым в просвет кишечника рецептором — трансферрином. Трансферрин с железом подвергается эндоцитозу и в клетках передает железо другому кишечному транспортеру, известному под условным названием мобилферрин. Этот переносчик рециркулирует и отдаёт железо ферритину и трансферрину на противоположной стороне клеток, прилегающей к капиллярам. Кишечный трансферриновый рецептор возвращается на каёмчатый полюс энтероцита, а трансферрин геми- ческого полюса постоянно уходит в кровь.
Из состава кишечного ферритина железо может медленно переходить в трансферрин, этотпроцесс активизируется при компенсации железодефицита, когда трансферрина в энтероцитах делается больше, а ферритина — меньше. При избытке железа развиваются обратные тенденции, и ферритиновая фракция теряется со слущивающимися энтероцитами. Таким образом, система абсорбции железа может модулировать интенсивность этого процесса в широких пределах, усиливая и, при необходимости - ограничивая его поступление, при этом свободное токсическое железо в энтероците не появляется.
Показатели обеспеченности организма железом связаны с его белками- транспортёрами. В крови железо переносит оторвавшийся от клеток рецептор железа — трансферрин, гликопротеид (80 кД) с электрофоретическими свойствами ß-глобулина, связывающий 2 атома металла в ферри-форме каждой своею молекулой. Принципиально, все клетки, но в наибольшей степени — эритробласты и гепатоциты — способны к его экспрессии и продукции.
В клетках действует сервомеханизм, регулирующий экспрессию трансферринового гена — при низком внутриклеточном содержании железа особый железозависимый белок освобождается, связывается с регуляторным участком м-РНК и инициирует синтез трансферринового рецептора, что ведет к эндоцитозу трансферрина.
Сродство трансферрина, продукта дупликации древнего гена, к железу столь огромно, что при его нормальной выработке в литре крови присутствует, теоретически, лишь 1 атом свободного железа. Трансферрин — отрицательный глобулин острой фазы, его синтез при лихорадке понижают интерлейкины (IL-1 и IL-6).
Трансферрин переносит железо во многие ткани, в том числе — в основном, в костный мозг и захватывается его клетками, причем, как эритроидными, так и иными.
В эритроидных клетках железо делится между митохондриями, где включается в гем, и белком ферритином, а в миелоидных — существенная его часть попадает в защитный белок лактофер- рин, в макрофагах же — включается, в основном в ферритин.
Апоферритин содержит полость, где после образования из него ферритина хранится кристалл гидрата закиси железа, содержащий более 4000 атомов этого металла. Имеется целое семейство тканеспецифических ферритинов. Во многих тканях недостаток внутриклеточного железа подавляет синтез ферритина через особый железозависимый белок — лиганд соответствующей м- РНК. Ферритиновая форма хранения железа обеспечивает его депонирование, реутилизацию, а также, в небольгной мере — циркуляцию, так как некоторое количество бедного железом апо- ферритина имеется в плазме крови.
Из ферритиновой формы железо может эффективно мобилизоваться. Ферритиновые гранулы имеются, в наибольшем числе, в макрофагах костного мозга, селезёнки и печени и в си- деробластах — эритробластических клетках костного мозга.
При нарастающем дефиците железа их количество понижается, вплоть до исчезновения. После утилизации гема и гемоглобина, освобожденного при гемолизе, при участии гемопексина, гаптог- лобина механизмов аутофагоцитоза и эндоцитоза, железо снова попадает в макрофаги, в «ферритиновый футляр». Из ферритина железо мобилизуется быстро и регулируемым путём. Синтез ферритина в макрофагах стимулируется железом. С течением времени и, особенно, при избытке железа и при усиленном протекании в тканях свободнорадикальных процессов (где железо участвует в реакции Фентона, си. т. I данного издания, с. 187,192), ферритин превращается в гемосидерин.
Дата добавления: 2023-04-21; просмотров: 753;











