A) Кремниевые кислоты и их соли
Получение. Кремниевые кислоты не образуются при непосредственном взаимодействии SiО2 с Н2О. Однако при подкислении водных растворов силикатов (растворимого стекла) или при гидролизе некоторых бинарных соединений кремния (IV), например SiС14, образуется гидратированный диоксид кремния mSiO2*nН2О, выпадающий в осадок.
Состав и свойства. В водном растворе над осадком SiO2*nН2О существуют молекулы ортокремниевой кислоты состава Н4SiO4. Эта кислота малоустойчива. В концентрированных растворах ее молекулы самопроизвольно (лучше при подкислении) объединяются между собой с отщеплением воды и образуют цепи —Si—О—Si—О— сначала высокомолекулярных, а затем и коллоидных агрегатов. Конденсация молекул заканчивается образованием структур с пространственной сеткой. Такой процесс идет при обработке силиката натрия Nа2SiO3 (растворимого стекла) хлороводородной кислотой:
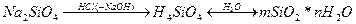
Осадок гидратированного диоксида кремния сначала вязкий, но он довольно быстро твердеет, переходя в бесцветный гель. При дальнейшем хранении на воздухе происходит постепенное обезвоживание геля и образуется непрозрачный, белый, чрезвычайно пористый продукт — силикагель. Как и активный уголь, силикагель используется в качестве адсорбента. Путем сильного прокаливания и последующего вымывания хлорида натрия получают мелкодисперсный белый порошок диоксида кремния SiO2 (белая сажа).
Соли кремниевых кислотназываются силикатами. Состав силикатов вывозится из формул кремниевых кислот общего состава SiO2*nН2О (при небольших целочисленных значениях тип):
| Состав | Кислота | Соль |
| SiO2*2H2O = Н4SiO4 | Ортокремневая | ортосиликаты |
| SiO2*H2O = Н2SiO3 | Метакремниевая | Метасиликаты |
| 2SiO2*3H2O = Н6S2O7 | Дикремниевая | дисиликаты |
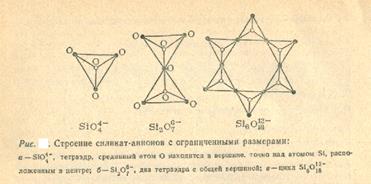
Строение силикатов. В ортосиликатах ион SiO44- имеет строение правильного тетраэдра, как, например, в минерале оливин (Мg, Fе2+)2 SiO4. В дисиликатах ион Si2O76- построен из двух одинаковых тетраэдров [SiO4], связанных общей вершиной (мостиковым атомом О), как, например, в минерале торт-вейтит Sс2(Si2O7). Число тетраэдров, соединенных вершинами, может увеличиваться при дальнейшей конденсации, в результате образуются кольцевые анионы типа Si6O1812-, встречающиеся, например, в минерале берилл Ве3А12(Si6O18). Строение анионов SiO44-, Si2O76- и Si6O1812- показано на рис. 1.


Наряду с указанными силикатионами, имеющими ограниченные размеры, существует огромное число силикат-ионов с неограниченными размерами. Тетраэдры [SiO4] могут объединяться, образуя цепочечные, ленточные, плоскостные и пространственные структуры, отрицательный заряд которых нейтрализуется положительными ионами металлов (рис. 2).
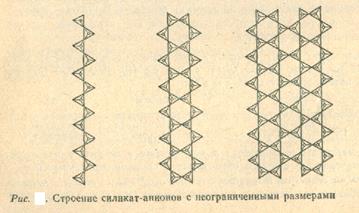
Силикаты с цепочечным и ленточным строением способны расщепляться на тонкие волокна (асбест), а с плоскостным строением легко расщепляются на отдельные пластины (слюды). Силикаты могут набухать в результате того, что молекулы Н2О размещаются между анионными слоями (глины).
Пространственно-сетчатое строение имеет сам диоксид кремния и многочисленные природные и искусственные алюмосиликаты (смешанные соли — алюминатсиликаты). В алюмосиликатах часть атомов кремния в тетраэдрах [SiO4] замещена на атомы А1, а поскольку положительный заряд атома алюминия на единицу меньше (А1+3 вместо Si+4), то отрицательный заряд алюмосиликатного иона возрастает на единицу и соответственно возрастает число необходимых для электронейтральности катионов. В химических формулах алюмосиликатов в состав аниона включают алюминий, замещающий кремний, а также указывают наименьшее возможное число атомов всех элементов, например для минерала ортоклаза (калиевый полевой шпат) записывают формулу К(А1Si3О8), хотя конечно, молекул и анионов такого состава в природе не встречается.
Пространственные сетки алюмосиликатов, относящиеся к цеолитам, избирательно включают и удерживают катионы определенных размеров, что используется в химической практике. Цеолиты являются природными ионообменниками, в каналах их пространственной сетки находятся ионы металлов, которые могут замещаться на катионы, размеры которых соизмеримы с размерами каналов.
Дата добавления: 2021-09-07; просмотров: 961;











