Электронные орбитали, подоболочки и оболочки атомов
В базовых для всего современного естествознания теориях строения атомов и химической связи физика и химия смыкаются. Основой этих теорий является механика микромира – квантовая механика.
Из квантовой механики (см. подраздел 9.3) известно, что состояние электрона в атоме может быть полностью охарактеризовано набором из четырех так называемых квантовых чисел:
n – главное квантовое число, которое может принимать любое значение из ряда натуральных чисел n = 1, 2, 3, и т. д.;
l – орбитальное квантовое число, которое при некотором заданном значении числа n может принимать любое из следующих n значений: l = 0, 1, 2, … 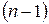 ;
;
m – магнитное квантовое число, которое при некотором заданном значении числа l может принимать любое из следующих 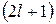 значений:
значений:  ;
;
 - магнитное спиновое квантовое число, которое для электрона может принимать одно из двух значений
- магнитное спиновое квантовое число, которое для электрона может принимать одно из двух значений 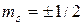 . Упрощенно считают, что двум различным значениям магнитного спинового квантового числа соответствуют два противоположных направления вращения электрона вокруг собственной оси.
. Упрощенно считают, что двум различным значениям магнитного спинового квантового числа соответствуют два противоположных направления вращения электрона вокруг собственной оси.
Для электронов, являющихся фермионами, то есть частицами с полуцелым спином, справедлив принцип Паули: в любой квантовой системе (атоме, молекуле, ионе) не может быть двух и более фермионов, находящихся в одинаковых состояниях, то есть имеющих одинаковые наборы значений всех четырех квантовых чисел. Математическое выражение принципа Паули:
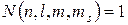 , (12.1)
, (12.1)
где 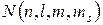 - максимальное количество электронов в атоме, имеющих определенный набор значений четырех квантовых чисел
- максимальное количество электронов в атоме, имеющих определенный набор значений четырех квантовых чисел  .
.
Энергия электрона в сложном (то есть содержащим более одного электрона) атоме зависит от главного квантового числа n, в меньшей степени – от орбитального числа l и увеличивается с ростом n и l.
Совокупность электронных состояний в атоме, имеющих одинаковый набор значений трех чисел 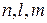 , но различные значения
, но различные значения  , называется электронной орбиталью. На одной орбитали может находиться не более двух электронов, так как значения чисел
, называется электронной орбиталью. На одной орбитали может находиться не более двух электронов, так как значения чисел 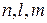 у них одинаковы, и отличаться они могут лишь значениями числа
у них одинаковы, и отличаться они могут лишь значениями числа  , а таких значений лишь два: +1/2 и –1/2. Максимальное число электронов на одной орбитали
, а таких значений лишь два: +1/2 и –1/2. Максимальное число электронов на одной орбитали
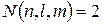 . (12.2)
. (12.2)
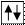 Условное обозначение целиком заполненной орбитали: .
Условное обозначение целиком заполненной орбитали: .
Две стрелки символизируют два электрона, а их противоположные направления – различные значения магнитного спинового квантового числа, то есть противоположные направления вращения электрона вокруг своей оси.

 Частично заполненная орбиталь изображается так , или так .
Частично заполненная орбиталь изображается так , или так .
 Пустая орбиталь .
Пустая орбиталь .
Совокупность состояний, имеющих одинаковые значения чисел 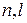 , но разные значения m и
, но разные значения m и  , называется электронной подоболочкой. Так как при заданном значении числа l число m может принимать
, называется электронной подоболочкой. Так как при заданном значении числа l число m может принимать 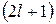 значений, то подоболочка, соответствующая числу l, содержит
значений, то подоболочка, соответствующая числу l, содержит 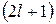 орбиталей. На каждой из орбиталей может находиться не более двух электронов, поэтому максимальное число электронов в подоболочке
орбиталей. На каждой из орбиталей может находиться не более двух электронов, поэтому максимальное число электронов в подоболочке
 . (12.3)
. (12.3)
Подоболочка, соответствующая l=0, называется s-подоболочкой. Так как при l=0 число m может принимать единственное значение m=0, то s-подоболочка содержит лишь одну орбиталь. На ней, как максимум, могут находиться два электрона, отличающихся значением  (
(  =+1/2 или
=+1/2 или  =-1/2), поэтому s-подоболочка может содержать, как максимум, два электрона, что следует и из формулы (12.3) при l=0.
=-1/2), поэтому s-подоболочка может содержать, как максимум, два электрона, что следует и из формулы (12.3) при l=0.
Подоболочка, соответствующая l=1, называется p-подоболочкой. Так как при l=1 число m может принимать три различных значения m= -1, 0, +1, то p-подоболочка содержит три орбитали. На каждой из орбиталей может находиться до двух электронов, поэтому p-подоболочка может содержать, как максимум, шесть электронов, что следует и из формулы (12.3) при l=1.
Подоболочка с l=2, называется d-подоболочкой. Она состоит из пяти орбиталей с m= -2, -1, 0, +1, +2 и может содержать, как максимум, 10 электронов.
Подоболочка с l=3 называется f-подоболочкой. Она состоит из семи орбиталей с m= -3, -2, -1, 0, +1, +2, +3 и может содержать до 14 электронов.
Максимальное число электронов на каждой последующей подоболочке на 4 больше, чем на предыдущей, то есть эти числа образуют арифметическую прогрессию 2, 6, 10, 14, … и т. д.
Совокупность состояний, имеющих одинаковое значение числа n, но разные значения  , называется электронной оболочкой или электронным слоем. Каждая оболочка состоит из n подоболочек, на каждой из которых может находиться не более
, называется электронной оболочкой или электронным слоем. Каждая оболочка состоит из n подоболочек, на каждой из которых может находиться не более 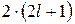 электронов, поэтому максимальное число электронов в оболочке рассчитывается как сумма членов арифметической прогрессии
электронов, поэтому максимальное число электронов в оболочке рассчитывается как сумма членов арифметической прогрессии
 . (12.4)
. (12.4)
n=1 соответствует K-слой, состоящий из единственной s-подоболочки, обозначаемой кратко как 1s, и содержащий, как максимум, два электрона.
n=2 соответствует L-слой, состоящий из s- и p-подоболочки, обозначаемых кратко 2s и 2p, и содержащий до восьми, то есть (2+6) электронов.
n=3 соответствует M-слой, состоящий из s-, p- и d-подоболочки, обозначаемых 3s, 3p и 3d, и содержащий до 18=(2+6+10) электронов.
n=4 соответствует N-слой, состоящий из s-, p-, d- и f-подоболочки, обозначаемых 4s, 4p, 4d и 4f, и содержащий до 32=(2+6+10+14) электронов.
Информация о максимальном количестве электронов в некоторых оболочках (слоях) и подоболочках сложных атомов представлена в таблице 12.1.
Таблица 12.1 - Количество возможных электронных состояний в первых слоях сложных атомов.
| n | ||||||||||
| Слой | K | L | M | N | ||||||
| ||||||||||
| l | ||||||||||
| Подоболочка | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f |
|
Дата добавления: 2020-10-25; просмотров: 511;











