Ароматичность гетероциклов. Типы гетероатомов
Рассмотрение электронного строения бензола и родственных соединений позволило выявить структурные и энергетические признаки, определяющие понятие ароматичность. Одним из них является правило Хюккеля, которое утверждает, что плоская циклическая структура является ароматической, если она содержит (4n+2)π-электронов, участвующих в формировании единой делокализованной π-электронной системы. Повышенная термодинамическая устойчивость ароматического соединения обусловлена делокализацией π-электронов. Одной из количественных характеристик ароматичности является энергия делокализации, которая для бензола составляет 153,2 кДж/моль (см. раздел 2.7).
К ароматическим системам относятся и некоторые карбоциклические соединения небензойного строения, соответствующие критериям ароматичности. Это, прежде всего, циклопентадиенильный анион и катион тропилия:
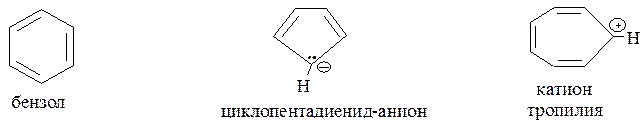
В молекуле бензола формирование ароматического π-секстета осуществляется при участии р-АО атомов углерода, находящихся в состоянии sp2-гибридизации.
Для того, чтобы гетероциклическая система была ароматической, необходимо, чтобы гетероатом по своему электронному вкладу в π-систему был бы эквивалентен, равноценен Сsp2-атому.
Это становится возможным благодаря участию р-орбитали неуглеродного атома, т.е. гетероатома, в образовании делокализованной 6π-электронной системы.
Понятно, что замена атома углерода в бензольном ядре на гетероатом приводит к нарушению симметрии, а это влечёт за собой уменьшение уровня делокализации π-электронов. Это очевидно, поскольку валентные углы и длины связей углерод-гетероатом не совпадают с таковыми бензольного ядра. Для сравнения приведём строение бензола и пиридина:
Рис. 24.1. Строение бензола (а) и пиридина (б)
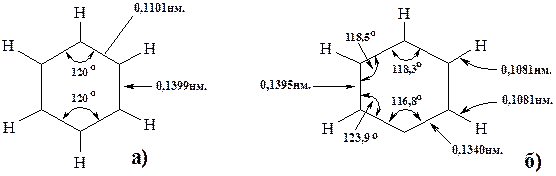
Плоскостное строение пиридина можно объяснить тем, что гетероатом азота находится в состоянии sp2-гибридизации.
Уместно напомнить, что плоская, тригональная геометрия атома углерода, как известно, обусловлена sp2-гибридизацией атомных орбиталей: гибридные орбитали, располагающиеся в одной плоскости, направлены под углом 120О, а негибридная рz-орбиталь перпендикулярна к этой плоскости.
Увеличение или уменьшение валентных углов, образуемых при участии sp2-гибридных орбиталей гетероатома объясняется природой гетероатома.
В молекуле пиридина так же, как и у бензола, имеется 6π-электронная система, сформированная за счет 5-ти электронов Сsp2атомов и одного электрона гетероатома азота. Таким образом, пиридин является изоэлектронным аналогом бензола.
 С другой стороны, от циклопентадиенильного аниона путём замены фрагмента на азот можно перейти к пятичленной гетероциклической системе – пирролу. Для соблюдения правила Хюккеля а пирроле необходимо, чтобы гетероатом предоставил π-систему два электрона:
С другой стороны, от циклопентадиенильного аниона путём замены фрагмента на азот можно перейти к пятичленной гетероциклической системе – пирролу. Для соблюдения правила Хюккеля а пирроле необходимо, чтобы гетероатом предоставил π-систему два электрона:

Электронный вклад гетероатомов азота в формирование ароматического π-секстета гетероциклов неодинаковый: в пиридине гетероатом азота предоставляет один электрон, а в пирроле – неподелённую пару.
Какая же разница между этими гетероатомами?
В основном состоянии внешняя оболочка азота имеет конфигурацию s2p3. Если допустить, что образование трёх связей с водородом осуществляется при участии трёх негибридных 2р-орбиталей, то в этом случае валентный угол в аммиаке составил бы 90о. Однако в аммиаке, имеющем пирамидальное строение, валентный угол H–N–H равен 107,3о, а атом азота находится примерно в sp3-гибридном состоянии.
Что же касается гетероатома азота, то он находится в состоянии sp2-гибридизации как в пиридине, так и в пирроле. Разница состоит в том, на какой орбитали располагается неподелённая пара электронов.
Пиррольный гетероатом азота находится в состоянии sp2-гибридизации, что соответствует плоской, тригональной геометрии гибридных орбиталей, располагающихся в одной плоскости под углом 120о. Неподелённая пара электронов занимает негибридную 2р-орбиталь, направленную перпендикулярно к плоскости трёх гибридных орбиталей. В пирроле для формирования ароматического π-секстета гетероатом азота предоставляет свою неподелённую пару электронов.
Пиридиновый гетероатом азота также находится в состоянии sp2-гибридизации, но долевое участие орбиталей в гибридизации в этом случае отличается от пиррольного. В пиридиновом азоте в гибридизации участвует s-орбиталь с размещёнными на ней двумя электронами и две р-орбитали. Это приводит к тому, что у такого атома азота неподелённая пара электронов занимает одну из трёх sp2-гибридных орбиталей, располагающихся в одной плоскости под углом 120о (тригональная геометрия). На негибридной рz-орбитали в этом случае находится один электрон. В образовании двух связей –С=N– и N–C= от гетероатома азота участвуют две из трёх гибридные орбитали. Третья гибридная орбиталь, на которой находится неподелённая пара электронов, не принимает участия в образовании связей, располагаясь под небольшим углом к плоскости цикла:
Рис. 24.2. Строение пиридинового и пиррольного гетероатома азота и их участие в построении гетероцикла

Сравнивая между собой пиррол и циклопентадиенильный анион, мы убеждаемся, что они являются изоэлектронными аналогами.
В построении пиррольного гетероцикла помимо гетероатома азота участвуют четыре углеродных атома – Сsp2, каждый из которых содержит по одной негибридной pz-орбитали, заселённой одним электроном.
Четыре pz-орбитали (по одной от каждого атома углерода) и негибридная pz-орбиталь гетероатома азота с неподелённой парой электронов, перекрываясь, формируют единое делокализованное 6π-электронное облако, распределённое между пятью атомами в цикле. Из этого следует, что пиррол является π-избыточной системой.
Таким образом, чтобы в пятичленном гетероцикле, состоящем из четырёх атомов Сsp2 и одного гетероатома (любого), выполнялось правило Хюккеля, гетероатом должен вносить в π-систему два электрона.
Дата добавления: 2020-10-01; просмотров: 702;











