Строение сложных атомов. Обоснование периодического закона Д.И. Менделеева
Количество электронов, находящихся в любой подоболочке или оболочке, не может превысить ее указанную выше «вместимость». Поэтому при возрастании порядкового номера атома и соответствующем увеличении числа электронов они должны заполнять все новые и новые подоболочки и слои. Заполнение орбиталей, подоболочек и оболочек при увеличении числа электронов идет в порядке возрастания энергии. При этом выполняются два правила Клечковского:
1) в первую очередь заполняются подоболочки с наименьшим значением суммы  ;
;
2) если у нескольких подоболочек значения  одинаковы, то их заполнение происходит в порядке возрастания n.
одинаковы, то их заполнение происходит в порядке возрастания n.
В соответствии с этими правилами очередность заполнения подоболочек такова (над обозначением каждой подоболочки в скобках указано соответствующее значение суммы  ):
):
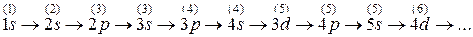 (12.5)
(12.5)
Наглядно распределение электронов по состояниям можно представить с помощью энергетической диаграммы для сложных атомов, представленной на рисунке 12.1. На этом рисунке по вертикальной оси отложена энергия электронов, а в виде горизонтальных отрезков (энергетических уровней) показаны значения энергии электронов для первых подоболочек и оболочек. Эти разрешенные значения энергии образуют энергетический спектр электронов в сложных атомах.
Из схемы (12.5) и рисунка 12.1 следует, что вначале целиком заполняется первый слой, затем целиком второй слой, при заполнении последующих слоев ситуация усложняется. У третьего слоя вначале заполняются подоболочки 3s и 3p, затем подоболочка 4s четвертого слоя, и лишь затем завершается заполнение третьего слоя (подоболочки 3d). Далее продолжается заполнение четвертого слоя (подоболочка 4p), потом начинается заполнение пятого слоя (подоболочка 5s) и так далее в соответствии с правилами Клечковского.
 При распределении электронов по орбиталям в пределах одной подоболочки выполняется правило Хунда: в основном, то есть невозбужденном, состоянии атома электроны распределяются по орбиталям так, чтобы их суммарный спин был максимален.
При распределении электронов по орбиталям в пределах одной подоболочки выполняется правило Хунда: в основном, то есть невозбужденном, состоянии атома электроны распределяются по орбиталям так, чтобы их суммарный спин был максимален.
Рисунок 12.1 - Энергетический спектр электронов в сложных атомах. Над каждым энергетическим уровнем указано обозначение соответствующей подоболочки и ее «вместимость» (в скобках). Чтобы подчеркнуть, что уровень 4s имеет энергию, меньшую энергии уровня 3d, уровень 4s продлен пунктиром. Аналогично показано, что уровень 5s ниже уровня 4d.
Электронная конфигурация атома, то есть распределение электронов по подоболочкам и оболочкам в атоме описывается символическими формулами, где последовательно перечисляются целиком и частично заполненные подоболочки и в виде верхних индексов указывается количество электронов в каждой из этих подоболочек. Например, электронная конфигурация атома кислорода, имеющего восемь электронов, описывается формулой  .
.
Далее приведены формулы электронной конфигурации и распределения электронов по орбиталям для первых 11 элементов таблицы Д.И. Менделеева (нижний левый индекс указывает порядковый номер Z элемента в таблице Д.И. Менделеева, то есть число протонов в ядре атома и число электронов, окружающих ядро).
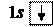 1. Водород 1H: формула
1. Водород 1H: формула 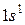 ,
,
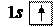 распределение по состояниям или
распределение по состояниям или
 2. Гелий 2He: формула
2. Гелий 2He: формула 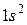 , распределение по состояниям
, распределение по состояниям

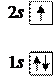 3. Литий 3Li:
3. Литий 3Li: 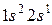 , распределение по состояниям или
, распределение по состояниям или
 4. Бериллий 4Be:
4. Бериллий 4Be: 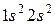
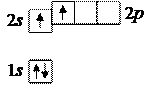 Реакционная способность атомов, то есть их способность соединяться с другими атомами и создавать молекулы, определяется наличием неспаренных электронов, то есть электронов, находящихся на орбиталях в одиночестве. Валентность атома, то есть способность образовывать определенное число связей с другими атомами, определяется числом неспаренных электронов. Из приведенных примеров видно, что водород и литий – одновалентные элементы, а у гелия нет неспаренных электронов, поэтому он химически инертен, то есть не способен образовывать молекулы. Так и есть в действительности. Но из распределения электронов по состояниям может показаться, что и бериллий химически инертен, хотя в действительности он способен к химическим реакциям и проявляет валентность, равную двум, например, при образовании оксида BeO. Это объясняется тем, что за счет небольшого увеличения энергии атом бериллия может перейти в возбужденное состояние Be*, в котором один из электронов из подоболочки 2s переходит на одну из орбиталей подоболочки 2p и электроны по орбиталям распределяются так:
Реакционная способность атомов, то есть их способность соединяться с другими атомами и создавать молекулы, определяется наличием неспаренных электронов, то есть электронов, находящихся на орбиталях в одиночестве. Валентность атома, то есть способность образовывать определенное число связей с другими атомами, определяется числом неспаренных электронов. Из приведенных примеров видно, что водород и литий – одновалентные элементы, а у гелия нет неспаренных электронов, поэтому он химически инертен, то есть не способен образовывать молекулы. Так и есть в действительности. Но из распределения электронов по состояниям может показаться, что и бериллий химически инертен, хотя в действительности он способен к химическим реакциям и проявляет валентность, равную двум, например, при образовании оксида BeO. Это объясняется тем, что за счет небольшого увеличения энергии атом бериллия может перейти в возбужденное состояние Be*, в котором один из электронов из подоболочки 2s переходит на одну из орбиталей подоболочки 2p и электроны по орбиталям распределяются так:
Возбужденный атом Be* имеет два неспаренных электрона, что и объясняет его двухвалентность. Спины обоих неспаренных электронов сонаправлены, чтобы в соответствии с правилом Хунда общий спин электронов атома был максимален.
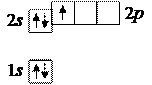 5. Бор 5В: в основном состоянии
5. Бор 5В: в основном состоянии 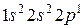
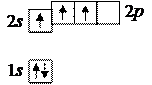 При таком распределении электронов бор был бы одновалентным, но в действительности он проявляет валентность, равную трем, как, например, в оксиде B2O3. Так получается из-за перехода атома в возбужденное состояние B*, в котором распределение электронов таково:
При таком распределении электронов бор был бы одновалентным, но в действительности он проявляет валентность, равную трем, как, например, в оксиде B2O3. Так получается из-за перехода атома в возбужденное состояние B*, в котором распределение электронов таково:
При этом атом бора имеет три неспаренных электрона, что и объясняет его трехвалентность.
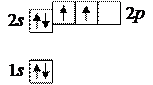 6. Углерод 6С: в основном состоянии формула
6. Углерод 6С: в основном состоянии формула 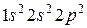 и распределение электронов с учетом правила Хунда таково:
и распределение электронов с учетом правила Хунда таково:
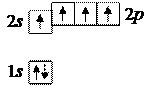 При этом углерод двухвалентен, как, например, при образовании одного из оксидов – угарного газа СО. Однако, чаще углерод четырехвалентен, как в другом оксиде – углекислом газе СО2. Валентность, равная четырем, опять же достигается за счет перехода атома в возбужденное состояние C* с четырьмя неспаренными электронами:
При этом углерод двухвалентен, как, например, при образовании одного из оксидов – угарного газа СО. Однако, чаще углерод четырехвалентен, как в другом оксиде – углекислом газе СО2. Валентность, равная четырем, опять же достигается за счет перехода атома в возбужденное состояние C* с четырьмя неспаренными электронами:
Так теория строения атомов объясняет тот факт, что некоторые элементы способны проявлять различную валентность.
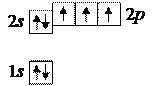 7. Азот 7N:
7. Азот 7N:  :
:
При таком распределении электронов азот трехвалентен.
 8. Кислород 8О:
8. Кислород 8О:  :
:
Эта схема объясняет двухвалентность кислорода.
 9. Фтор 9F:
9. Фтор 9F: 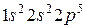
Фтор одновалентен.
 10. Неон 10Ne:
10. Неон 10Ne: 
Видно, что у неона целиком заполнены первые две оболочки: K-оболочка и L-оболочка, и нет неспаренных электронов. Поэтому неон химически инертен.
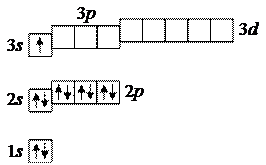 11. Натрий 11Na. У натрия начинается заполнение 3s-подоболочки M-слоя. Формула
11. Натрий 11Na. У натрия начинается заполнение 3s-подоболочки M-слоя. Формула  , схема распределения электронов такова:
, схема распределения электронов такова:
Очевидно, что натрий одновалентен.
Химические свойства атомов в основном определяются наличием (или отсутствием) неспаренных (валентных) электронов, располагающихся в частично заполненных (валентных) подоболочках. У многих элементов валентные подоболочки находятся на большем среднем расстоянии от ядра, чем целиком заполненные, и поэтому называются внешними. Очень важно, что строение валентных оболочек повторяется. Так у лития и следующего через восемь номеров натрия имеется по одному валентному электрону, находящемуся в s-подоболчке (2s у Li, 3s у Na). Еще через восемь номеров находится калий 19K, у которого электронная конфигурация такова: 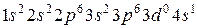 , то есть также имеется один неспаренный электрон во внешней s-подоболочке. Далее период повторяемости несколько изменяется: с интервалом в 18 номеров следуют рубидий 37Ru и цезий 55Cs, у которых также имеется по одному валентному электрону во внешней s-подоболочке. Следующий аналогичный элемент – франций 87Fr – находится в таблице Д.И. Менделеева через 32 номера после цезия. Сходство в строении электронных оболочек приводит к сходству химических свойств перечисленных элементов: все они одновалентные металлы, имеют высокую реакционную способность, образуют гидроксиды LiOH, NaOH, KOH, …, которые все являются сильными щелочами, и т.д. Эти элементы называют щелочными металлами и объединяют в подгруппу Iа первой группы, иногда добавляя в нее также и водород, имеющий единственный электрон в s-подоболочке.
, то есть также имеется один неспаренный электрон во внешней s-подоболочке. Далее период повторяемости несколько изменяется: с интервалом в 18 номеров следуют рубидий 37Ru и цезий 55Cs, у которых также имеется по одному валентному электрону во внешней s-подоболочке. Следующий аналогичный элемент – франций 87Fr – находится в таблице Д.И. Менделеева через 32 номера после цезия. Сходство в строении электронных оболочек приводит к сходству химических свойств перечисленных элементов: все они одновалентные металлы, имеют высокую реакционную способность, образуют гидроксиды LiOH, NaOH, KOH, …, которые все являются сильными щелочами, и т.д. Эти элементы называют щелочными металлами и объединяют в подгруппу Iа первой группы, иногда добавляя в нее также и водород, имеющий единственный электрон в s-подоболочке.
Такая же периодичность свойств наблюдается у других элементов, объединяемых в соответствующие группы и подгруппы. Например подгруппу IIа образуют так называемые щелочноземельные металлы: бериллий 4Be, магний 12Mg, кальций 20Ca, стронций 38Sr, барий 56Ba, радий 88Ra. У всех этих элементов, как у рассмотренного выше бериллия, в основном состоянии имеется по два электрона во внешней s-подоболочке. Сходство строения валентных оболочек приводит к тому, что у щелочноземельных металлов также схожи и химические свойства.
Еще одним ярким примером повторяемости химических свойств являются благородные (инертные) газы, фактически не образующие химических соединений. К ним относятся уже рассмотренные выше гелий 2He, неон 10Ne, а также аргон 18Ar, криптон 36Kr, ксенон 54Xe, радон 86Rn. У всех этих элементов нет частично заполненных подоболочек, то есть нет неспаренных электронов, что и объясняет их химическую инертность.
Таким образом, теория строения сложных атомов объясняет периодический закон Д.И. Менделеева.
Химическая связь
При взаимодействии атомов между ними может возникнуть химическая связь, что ведет к образованию устойчивой многоатомной структуры – молекулы или молекулярного иона. Связью атомов, а также молекул и ионов, объясняется и образование твердых тел, свойства жидкостей и реальных газов и проч.
Некоторые характеристики химических связей:
- характеристика прочности связи - энергия разрыва одиночной связи (измеряется в электронвольтах) или молярная энергия связи (энергия для разрыва связей в одном моле вещества, измеряется в Дж/моль);
- длина связи;
- полярность связи, то есть смещение электрического заряда в сторону одного из взаимодействующих атомов.
Основное условие образования химической связи при взаимодействии частиц – уменьшение потенциальной энергии системы этих частиц в результате их взаимодействия. Это условие связано с известным из механики (см. § 6.5) утверждением о том, что состоянию устойчивого равновесия механической системы соответствует минимум ее потенциальной энергии.
Образование молекул обусловлено главным образом следующими двумя типами связи:
- ковалентная связь;
- ионная связь.
Эти связи прочные, так как энергия обоих этих видов связи велика (достигает ~106 Дж/моль).
Кроме того, возможны и другие виды связей между атомами и молекулами:
- металлическая связь (по прочности соизмерима с ковалентной и ионной, играет главную роль в объединении огромного числа частиц в металле);
- связь Ван-дер-Ваальса (наиболее универсальный, но и наиболее слабый вид связи с энергией ~104 Дж/моль);
- водородная связь (относительно слабая связь между молекулами, но играющая важную роль в природе, например, обуславливающая замечательные свойства льда и жидкой воды).
Электронную теорию ковалентной связи впервые независимо выдвинули в 1916 г. Г.Н. Льюис (амер.) и В. Коссель (нем.). Строгая теория ковалентной связи была разработана на основе квантовой механики. Первый количественный квантово-механический расчет молекулы с ковалентной связью атомов (на примере молекулы Н2) выполнили в 1927 г. В. Гайтлер (Германия – Англия – Ирландия – Швейцария) и Ф. Лондон (Германия – Англия – Франция - США) и этим заложили основы квантовой химии.
Современная теория ковалентной связи базируется на следующих положениях квантовой механики (см. раздел 9). Движение электронов имеет вероятностный характер. Распределение вероятности нахождения электрона в пространстве описывается волновой функцией 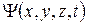 : квадрат модуля этой функции дает плотность вероятности нахождения частицы в точке с координатами
: квадрат модуля этой функции дает плотность вероятности нахождения частицы в точке с координатами  в момент времени t. Каждой орбитали соответствует своя волновая функция, то есть свое распределение в пространстве вероятности нахождения электрона. Эти распределения изображаются в виде так называемых «электронных облаков».
в момент времени t. Каждой орбитали соответствует своя волновая функция, то есть свое распределение в пространстве вероятности нахождения электрона. Эти распределения изображаются в виде так называемых «электронных облаков».
 Для электронов на s-орбиталях (то есть при орбитальном квантовом числе l=0) волновые функции и распределения вероятности обладают сферической симметрией, то есть зависят только от расстояния r до ядра атома. «Электронные облака» для s-орбиталей имеют форму шара. Для электронов на 2p-орбиталях (при l=1) «электронные облака» имеют гантелевидную форму. Схематические изображения «электронных облаков» показаны на рисунках 12.2 и 12.3.
Для электронов на s-орбиталях (то есть при орбитальном квантовом числе l=0) волновые функции и распределения вероятности обладают сферической симметрией, то есть зависят только от расстояния r до ядра атома. «Электронные облака» для s-орбиталей имеют форму шара. Для электронов на 2p-орбиталях (при l=1) «электронные облака» имеют гантелевидную форму. Схематические изображения «электронных облаков» показаны на рисунках 12.2 и 12.3.
Рисунок 12.2 – «Электронные облака» 1s-орбиталей.
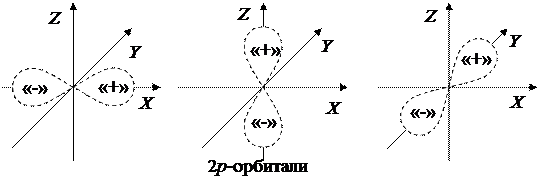 |
Рисунок 12.3 – «Электронные облака» 2p-орбиталей.
При сближении двух атомов и перекрытии их «электронных облаков» возможно как увеличение потенциальной энергии системы – в этом случае связь не образуется, так и уменьшение этой энергии – в этом случае между атомами возникает химическая связь. Последнее возможно, если на перекрывающихся орбиталях имеется по одному электрону с противоположными спинами, и знаки волновых функций в области перекрытия одинаковы. При этом плотность «электронного облака» в области перекрытия возрастает, то есть электроны преимущественно находятся в этой области и притяжение положительно заряженных атомных ядер к этой области компенсирует электрическое отталкивание ядер. На рисунке 12.4а показано образование области с повышенной вероятностью нахождения электронов при перекрытии 1s-орбиталей атомов водорода, то есть при образовании молекулы H2.
 |
 Рисунок 12.4 – а) Возникновение
Рисунок 12.4 – а) Возникновение  -связи и образование молекулы Н2 при перекрытии 1s-орбиталей двух атомов Н. Заштрихована область перекрытия «электронных облаков», – атомное ядро, «+» и «-» - знаки волновой функции, стрелки символизируют спин электрона. б) Возникновение
-связи и образование молекулы Н2 при перекрытии 1s-орбиталей двух атомов Н. Заштрихована область перекрытия «электронных облаков», – атомное ядро, «+» и «-» - знаки волновой функции, стрелки символизируют спин электрона. б) Возникновение  -связи при перекрытии вытянутых навстречу друг другу 2p-орбиталей двух атомов азота. в) Возникновение
-связи при перекрытии вытянутых навстречу друг другу 2p-орбиталей двух атомов азота. в) Возникновение 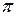 -связи при перекрытии перпендикулярных оси молекулы 2p-орбиталей двух атомов азота. На рисунках б) и в) спины взаимодействующих электронов противоположны.
-связи при перекрытии перпендикулярных оси молекулы 2p-орбиталей двух атомов азота. На рисунках б) и в) спины взаимодействующих электронов противоположны.
Так как все электроны тождественны, то при образовании ковалентной связи каждый из взаимодействующих электронов в равной мере принадлежит обоим атомам – происходит, как говорят, обобществление электронов соседних атомов.
Если область перекрытия электронных облаков лежит на линии, соединяющей центры атомов, то образуется так называемая  -связь, если же возникают две области перекрытия, не лежащие на линии, соединяющей центры атомов, то такую связь называют
-связь, если же возникают две области перекрытия, не лежащие на линии, соединяющей центры атомов, то такую связь называют 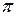 -связью. Пример
-связью. Пример  -связи показан на рисунке 12.4а. При образовании молекулы N2 возникают три ковалентных связи (тройная связь), так как у каждого из взаимодействующих атомов азота имеется по три неспаренных валентных электрона, находящихся на 2p-орбиталях, показанных на рисунке 12.3. При этом возникает как
-связи показан на рисунке 12.4а. При образовании молекулы N2 возникают три ковалентных связи (тройная связь), так как у каждого из взаимодействующих атомов азота имеется по три неспаренных валентных электрона, находящихся на 2p-орбиталях, показанных на рисунке 12.3. При этом возникает как  -связь при перекрытии облаков, вытянутых вдоль линии, соединяющей центры атомов (рисунок 12.4б), так и две
-связь при перекрытии облаков, вытянутых вдоль линии, соединяющей центры атомов (рисунок 12.4б), так и две 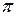 -связи при перекрытии облаков, перпендикулярных оси молекулы (пример – на рисунке 12.4в).
-связи при перекрытии облаков, перпендикулярных оси молекулы (пример – на рисунке 12.4в).
Химическая связь двух атомов условно изображается несколькими способами, представленными на рисунках 12.5 и 12.6. В подробном варианте изображаются валентные орбитали и двойными волнистыми линиями показываются связи. В формулах Льюиса точки рядом с символом элемента изображают электроны внешних оболочек атома, а сдвоенные точки, размещенные между атомами, символизируют связь (три пары точек между атомами в молекуле N2 символизируют тройную связь). В структурных формулах каждая черточка между атомами заменяет пару точек в формулах Льюиса.
 |
Рисунок 12.5 – Обозначение химической связи при образовании молекулы H2: а) подробное изображение; б) формула Льюиса; в) структурная формула.
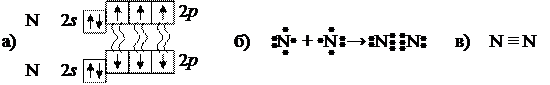 |
Рисунок 12.6 – Обозначение тройной химической связи при образовании молекулы N2: а) подробное изображение (показаны лишь электроны внешних подоболочек); б) формула Льюиса; в) структурная формула.
Характерные особенности ковалентной связи:
- насыщаемость - атом может установить только определенное число связей;
- направленность – связь ориентирована в пространстве определенным образом.
Ковалентная связь может быть неполярной – электронная пара симметрична относительно обоих атомов (пример – молекула О2), и полярной – электроны смещены к одному из атомов (пример, показанный на рисунке 12.7, - молекула HF). При этом действует правило октетов: атомы стремятся присоединить или отдать столько электронов, чтобы внешняя оболочка была как у инертного газа, то есть содержала октет (восемь) электронов
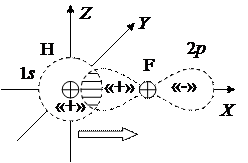
Рисунок 12.7 – Возникновение  -связи и образование молекулы НF при перекрытии 1s-орбитали атома Н и 2p-орбитали атома F. Стрелка указывает направление смещения электронной пары.
-связи и образование молекулы НF при перекрытии 1s-орбитали атома Н и 2p-орбитали атома F. Стрелка указывает направление смещения электронной пары.
Существуют и более сложные варианты ковалентной связи.
Многоцентровая связь, когда обобществляются электроны не двух, а большего числа атомов. Например, в молекуле бензола С6Н6 обобществлены шесть p-электронов всех шести атомов углерода, образующих кольцо (см. рисунок 12.8).
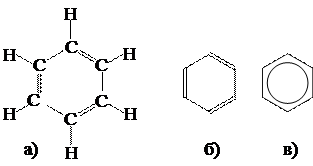
Рисунок 12.8 – Структурная формула бензола С6Н6: а) подробный вариант; б) сокращенный вариант; в) сокращенный вариант, более правильно отражающий обобществление электронов.
Химическая связь с гибридизацией орбиталей. Например, к образованию гибридных орбиталей способен возбужденный атом углерода С*, имеющий в L-слое один электрон в 2s-подоболочке и 3 электрона в 2p-подоболочке. При образовании атомом углерода четырех одинарных  -связей с другими атомами волновые функции этих четырех электронов перераспределяются в пространстве и возникают четыре равноценные гибридные sp3-орбитали, «электронные облака» которых изображены на рисунке 12.9.
-связей с другими атомами волновые функции этих четырех электронов перераспределяются в пространстве и возникают четыре равноценные гибридные sp3-орбитали, «электронные облака» которых изображены на рисунке 12.9.
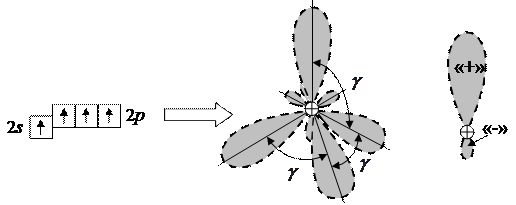
Рисунок 12.9 – «Электронные облака» четырех гибридных sp3-орбиталей в атоме углерода. В правой части рисунка – одна из четырех sp3-орбиталей. Угол между осями «облаков» 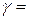 109.47°.
109.47°.
Ионная связь – предельный случай полярной ковалентной связи, когда электрон от одного атома целиком переходит к другому атому, и атомы превращаются в разноименно заряженные ионы, связанные кулоновской силой притяжения. Типичный пример вещества с ионной связью – хлорид натрия (поваренная соль) NaCl. Атом натрия отдает единственный электрон с 3s-подоболочки на единственное вакантное место в 3p-подоболочке атома хлора. После этого атом натрия превращается в положительный ион Na+, а атом хлора – в отрицательный ион Cl –, между которыми возникает электростатическое притяжение. Кристалл поваренной соли представляет собой одну гигантскую макромолекулу (NaCl)n, в которой чередуются ионы Na+ и Cl –.
Как уже отмечалось, под валентностью элемента понимают способность атомов этого элемента соединяться с другими атомами в определенных целочисленных соотношениях, то есть образовывать определенное число связей. Как правило, валентность определяют по числу присоединяемых атомов водорода (его валентность равна единице) или атомов кислорода (его валентность равна двум). Многие элементы имеют переменную валентность. В подразделе 12.2 рассмотрено строение атомов углерода с валентностью, равной 2 (в основном состоянии) и 4 (в возбужденном состоянии). Сера 16S в соединениях H2S, SO2, SO3 проявляет валентность, равную, соответственно, 2, 4 и 6. Как и для углерода, переменная валентность серы объясняется увеличением числа неспаренных электронов при возбуждении атома серы, как показано на рисунке 12.10. На этом рисунке изображено перераспределение шести электронов по подоболочкам 3s, 3p и 3d внешнего M-слоя. Остальные 10 электронов атома серы заполняют до предела внутренние оболочки, мало влияют на химические свойства атома и на рисунке 12.10 не показаны.
 |
Рисунок 12.10 – Распределение электронов по орбиталям M-слоя в атоме серы: а) невозбужденный атом двухвалентной серы; б) возбужденный атом четырехвалентной серы; в) еще более возбужденный атом шестивалентной серы.
Дата добавления: 2020-10-25; просмотров: 484;











