Вследствие разности электроотрицательностей атомов или групп
ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКОЙ ХИМИИ
Представление о взаимном влиянии атомов в молекулах было заложено еще в теории химического строения А.М.Бутлерова. Он писал: "...мы имеем право сказать, что, например, в CH3Cl три атома водорода и атом хлора, будучи связаны с углеродом, не соединены непосредственно между собой; в CH2O также водород и кислород соединены атомом углерода и не соединены между собой. Из того, однако же, вовсе не следует, чтобы атомы эти вовсе не обнаруживали друг на друга никакого влияния" (А.М.Бутлеров. Избранные работы. Изд. АН СССР, 1951. С.452).
Эти представления далее были развиты в работах ученика Бутлерова — В.В.Марковникова, который сделал ряд важных общих заключений, касающихся взаимного влияния атомов при реакциях замещения, при образовании непредельных соединений и в процессах присоединения к последним галогеноводородов и воды. В результате были сформулированы известные правила, носящие его имя (Ученые записки Казанского университета. 1869).
Эти вопросы и сейчас привлекают внимание химиков-органиков, стремящихся установить закономерности многообразных взаимодействии между непосредственно не связанными атомами в молекулах.
Индуктивный эффект
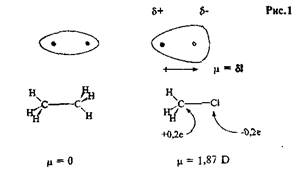 Ковалентная σ-связь между двумя атомами создается парой электронов, образующих общее для этих атомов электронное облако, максимум плотности которого расположен на прямой между ядрами атомов ("электронная плотность" характеризует вероятность нахождения электрона в данной точке пространства). Если связанные атомы (или группы атомов) одинаковы, то электроны связи в равной степени принадлежат им обоим, электронное облако симметрично относительно ядер атомов, и такая связь называется неполярной. Значительно чаще встречаются σ-связи между разными атомами (группами). Электронная плотность в таких связях смещена к одному из атомов, который тем самым получает дополнительный (избыточный) отрицательный заряд, составляющий небольшую часть от единичного заряда электрона (δ–). Второй атом связи также несет частичный заряд, но положительный (δ+) (это означает неполную компенсацию положительного заряда ядра отрицательным зарядом электронов). В результате связь длиной l приобретает дипольный момент, μ = δl, и называется полярной. Единица измерения дипольного момента - дебай (D). Стрелка и —► используется для указания направления полярности.
Ковалентная σ-связь между двумя атомами создается парой электронов, образующих общее для этих атомов электронное облако, максимум плотности которого расположен на прямой между ядрами атомов ("электронная плотность" характеризует вероятность нахождения электрона в данной точке пространства). Если связанные атомы (или группы атомов) одинаковы, то электроны связи в равной степени принадлежат им обоим, электронное облако симметрично относительно ядер атомов, и такая связь называется неполярной. Значительно чаще встречаются σ-связи между разными атомами (группами). Электронная плотность в таких связях смещена к одному из атомов, который тем самым получает дополнительный (избыточный) отрицательный заряд, составляющий небольшую часть от единичного заряда электрона (δ–). Второй атом связи также несет частичный заряд, но положительный (δ+) (это означает неполную компенсацию положительного заряда ядра отрицательным зарядом электронов). В результате связь длиной l приобретает дипольный момент, μ = δl, и называется полярной. Единица измерения дипольного момента - дебай (D). Стрелка и —► используется для указания направления полярности.
Согласно октетной теории Льюиса атомы стремятся обладать устойчивой, заполненной электронной оболочкой, соответствующей электронной конфигурации инертных газов. У элементов второго периода внешняя электронная оболочка способна вместить 8 электронов (октет). Атомы элементов, расположенные справа от углерода (правый верхний угол таблицы Менделеева), имеют тенденцию "захватывать" электроны для формирования электронной оболочки последующего инертного газа (O,F => Ne). Атомы элементов, расположенные слева от углерода, склонны "терять" электроны и образовывать электронную оболочку предыдущего инертного газа (Nе <= Na, Mg). Углерод, занимающий центральное положение, может с одинаковым успехом отдавать и принимать электроны.
Способность атома смещать электроны связи, притягивать их к себе, характеризуется его электроотрицательностью (χ). Чем больше различие электроотрицательностей связанных атомов, тем сильнее электроны связи смещены к одному из них - более электроотрицательному.
Углерод и водород имеют близкие электроотрицательности, связь С–Н принято считать практически неполярной. Связь между углеродом и более электроотрицательным элементом, таким как азот, кислород, фтор или хлор, поляризована так, что связывающие электроны смещены от углерода к этому второму атому. Углерод приобретает частичный положительный заряд (недостаток электронов), а электроотрицательный атом – частичный отрицательный. Например, связь С–Сl в хлорметане – полярная ковалентная связь (Рис.1). Связи между углеродом и менее электроотрицательными элементами поляризованы так, что атом С несет частичный отрицательный заряд, а второй атом – частичный положительный. Хорошим примером являются некоторые металлоорганические соединения, такие, как тетраэтилсвинец — антидетонационная добавка к бензину ("этилированный" бензин). 
 Для теоретического определения понятия электроотрицательности и количественной ее оценки предложен ряд методов (Малликен, Полинг и др.). Наиболее простоэлектроотрицательность определяется (по Малликену) как полусумма потенциала ионизации (энергии, необходимой для отрыва электрона от атома) и сродства к электрону (энергетического выигрыша от присоединения электрона к атому): χ = 0,5(I + А). Соответственно этим подходам разработаны и различные шкалы электроотрицательностей. Обычно применяют термохимическую шкалу Полинга:
Для теоретического определения понятия электроотрицательности и количественной ее оценки предложен ряд методов (Малликен, Полинг и др.). Наиболее простоэлектроотрицательность определяется (по Малликену) как полусумма потенциала ионизации (энергии, необходимой для отрыва электрона от атома) и сродства к электрону (энергетического выигрыша от присоединения электрона к атому): χ = 0,5(I + А). Соответственно этим подходам разработаны и различные шкалы электроотрицательностей. Обычно применяют термохимическую шкалу Полинга:
[Смешение электронов Полинг охарактеризовал дополнительной энергией ионной составляющей связи А-В, добавляющейся к среднеарифметическому энергий ковалентных связей. А-А и В-В: ΔЕ(АВ) = E(AB)эксп - 0,5[Е(АА) + E(BB)] Разность электроотрицательностей атомов А и В определяется формулой: Δχ = 0,208(ΔЕ)1/2.]
Электроотрицательность элемента зависит от его положения в таблице Менделеева: она увеличивается внутри группы снизу вверх: (I < Вr < Cl < F), внутри периода - слева направо (Li < Be < В < С < N < О < F). Особенно важно сравнение с водородом: элементы, электроотрицательность которых меньше или равна 2,2, называют электроположительными, а элементы, электроотрицательность которых выше 2,2 - электроотрицательными.
Приведенные величины χне следует абсолютизировать, пытаясь определить все электронные смешения в молекуле путем сложения-вычитания указанных цифр. Во-первых, разнообразие определений понятия электроотрицательности привело к большому числу не вполне совпадающих рядов значений. Кроме того, только одновалентные атомы можно характеризовать электроотрицательностью элемента (Н, F, Cl, Вr, I). Прочие атомы, как правило, входят в состав функциональных групп (заместителей), где на них сильно влияют другие атомы группы. Например, свойства атома азота в группах –NH2, –NHOH, –N=O или –NO2 очень сильно различаются и не могут оцениваться довольно абстрактными свойствами элемента N. Для определения воздействия таких групп на молекулу используют групповые электроотрицательности. В этом случае электроотрицательность может быть представлена как характеристика первого атома, непосредственно присоединенного к остову молекулы (здесь - N), несколько измененная под влиянием присоединенных к нему других атомов (см. анализ взаимного влияния атомов при рассмотрении Индуктивного эффекта).
Более того, электроотрицательность атома зависит от гибридизации его валентных электронов. s-Электроны по сравнению с р-электронами занимают более компактную, сосредоточенную у атомного ядра орбиталь, сильнее притягиваются к ядру. Поэтому, чем больше "s-характер" орбитали, тем больше электроотрицательность атома по направлению связи, в которой данная орбиталь участвует (sp > sp2 > sp3). Для атома углерода эти величины составляют: 3.1 (sp; ≡С–), 2,8 (sp2; =С–) и 2,5 (sp3; –С–).
Смешение электронной плотности внутри σ-связей, происходящее
вследствие разности электроотрицательностей атомов или групп
называется индуктивным эффектом (I).
Электронодонорные (электроположительные) атомы (группы), имеющие тенденцию отдавать электроны, проявляют положительный индуктивный эффект (+I), а электроноакцепторные (электроотрицательные), оттягивающие электроны - отрицательный индуктивный эффект (–I). Направление смешения электронов обозначается стрелкой вдоль σ-связи: С→Х.
Атом полярной σ-связи, получивший частичный положительный заряд, становится более электроотрицательным и оттягивает электроны от связанного с ним третьего атома, тот в свою очередь - от четвертого, и т.д. Таким образом индуктивный эффект передается по цепи,но быстро затухает: он практически не ощущается уже через три σ-связи.
[Аналогичная поляризация связей может происходить через пространство (эффект поля). Разделить эти два явления трудно. В большинстве случаев достаточно рассматривать индуктивный эффект.]
Индуктивный эффект функциональной группы зависит в первую очередь от природы "определяющего", первого атома, через который заместитель присоединен к остову молекулы, а также от индуктивных эффектов связанных с ним атомов или групп.
В периодах –I-эффект растет слева направо: -NR2 < -OR < -F, а в группах - снизу вверх: I < Cl < Br < F, -SeR < -SR < -OR. Электроотрицательные заместители усиливают -I-эффект первого атома (-SR < -SOR < -SO2R < -SO3H; -C(=O)R < -C(=O)OH < -С(=O)Сl; -CH2Cl < -СНСl2 < -ССl3 < CF3), а электроположительные уменьшают (-NH2 > -NHR > -NR2). Наиболее сильным отрицательным индуктивным эффектом обладают группы, несущие полный положительный заряд: -O  R2 > -N
R2 > -N  R3. Ненасыщенные и ароматические заместители также проявляют небольшой –I-эффект: –С≡С > -Рh ≈ –С=С–С=С > –С=С >
R3. Ненасыщенные и ароматические заместители также проявляют небольшой –I-эффект: –С≡С > -Рh ≈ –С=С–С=С > –С=С >
–С–C=С. (см. выше о роли s-характера орбиталей). Далее приведен примерный ряд сравнения величин –I-эффекта для наиболее распространенных заместителей:

Набор заместителей, обладающих +I-эффектом, не так разнообразен. В первую очередь следует отметить различные алкильные группы, электронодонорная способность которых увеличивается с увеличением разветвленности:
–СН3 < –СН2СН3 < –СН(СН3)2 < –С(СН3)3 < металлы
Сильный +I-эффект проявляют атомы металлов в металлоорганических соединениях. Наибольших величин +I-эффект достигает в случае заряженных (ионных) групп.
Дата добавления: 2018-11-26; просмотров: 1090;











