Фазовые диаграммы. Тройная точка
Разные фазы одного и того же вещества могут находиться в равновесии, соприкасаясь друг с другом. Такое равновесие наблюдается лишь в ограниченном интервале температур, причем каждому значению температуры Т соответствует свое давление Р, при котором возможно равновесие. Для наглядного изображения фазовых превращений используются фазовые диаграммы состояний, на которых в координатах Р, Т задается зависимость между температурой фазового перехода и давлением. Строятся такие диаграммы на основе экспериментальных данных.
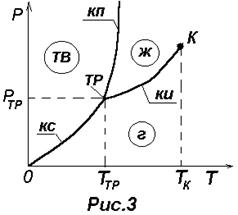
| На рис.3 изображена характерная диаграмма состояния вещества. Три фазы одного и того же вещества (твердая, жидкая и газообразная) могут находиться в равновесии только при единственном значении температуры ТТР и давлении РТР. Эту точку называют тройной (ТР). В тройной точке сходядтся три кривые равновесия фаз, взятых попарно: 1) кривая испарения (КИ) определяет условия равновесия между жидкой и газообразной фазами (например, между водой и водяным паром); |
2) кривая плавления (КП) определяет условия равновесия между твердой и жидкой фазами (например, между льдом и водой); 3) кривая сублимации (КС) определяет условия равновесия между твердой и газообразной фазами (например, между льдом и водяным паром). Каждое вещество имеет только одну тройную точку. Тройная точка воды имеет ТТР =273,16 К (или tТР=0,01°С) и РТР=611 Па, что соответствует 1/166 физической атмосферы. При такой температуре и давлении вода, лед и водяной пар находятся в равновесии, т.е. могут оставаться в таком состоянии сколь угодно долго.
Уравнение Клапейрона-Клаузиуса выражает связь наклона кривой равновесия двух фаз с теплотой фазового перехода q и изменением фазового объема V2-V1:
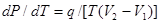 . (6)
. (6)
Дата добавления: 2016-07-27; просмотров: 1476;











