Уравнение Ван-дер-Ваальса (ВдВ)
В научной литературе существуют более 150 отличающихся друг от друга уравнений состояния реального газа. Среди них нет ни одного действительно верного и универсального.
Остановимся на уравнении ВдВ (1873 г). Он внес в уравнение Клапейрона-Менделеева PV=RT две поправки.
Первая поправка связана с действием сил отталкивания между молекулами. Она учитывает собственный объем молекулы V0 и поэтому объем сосуда V заменяют свободным объемом V-b, где b=4V0NA. В итоге получаем уравнение Клаузиуса для одного моля
P=RT/(V-b). (1)
Вторая поправка связана с действием сил притяжения между молекулами: в тонком поверхностном слое вблизи стенки сосуда на молекулу, подлетающую к стенке, действует сила притяжения со стороны остальных молекул газа, что приводит к уменьшению силы удара молекулы о стенку сосуда, а, следовательно, и давления на величину DP~ 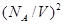 , в результате имеем P=RT/(V-b) – a/
, в результате имеем P=RT/(V-b) – a/ 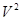 или
или
(P+ a/ 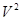 )(V-b)=RT, (2)
)(V-b)=RT, (2)
которое называют уравнением ВдВ для одного моля газа. В этом уравнении а и b – постоянные, зависящие только от вида газа.
Для произвольной массы газа уравнение ВдВ имеет вид
(P+ 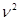 a/
a/ 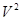 )(V-nb)= nRT, (3)
)(V-nb)= nRT, (3)
где n=m/M – число молей газа, m – масса газа, M – масса моля.
Дата добавления: 2016-07-27; просмотров: 2419;











