Положення елемента в періодичній системі та його здатність до комплексоутворення
Розглядаючи здатність елемента до комплексоутворення, необхідно враховувати різноманітність лігандів, які можуть координуватися з даним елементом, тобто різноманітність типів комплексних сполук, що він утворює, а також характер зв’язків між цим елементом і лігандом – йоннний чи ковалентний – та яка міцність цього зв’язку.
Міцність зв’язку залежить від багатьох факторів: заряду центрального йона і лігандів, знаку і величини заряду утвореного комплексу, наявність у внутрішній сфері циклічних угрупувань, що включають центральний йон, природи зовнішньої сфери.
Характеризуючи комплексоутворюючу здатність елемента, необхідно враховувати, що один і той же елемент в різних валентних станах може давати з одними і тими ж лігандами комплекси різної стійкості і кожен елемент утворює комплекси з лігандами, які містять певні атоми донора. Наприклад, елементи 2а групи утворюють комплекси з оксиген- і флуорвмісними лігандами, тоді як їх бромо- і йодокомплекси невідомі. Для найбільш типових комплексоутворювачів – елементів тріад восьмої групи – зв’язки Me–S та Me–N більш характерні і міцніші, ніж зв’язки Me–О. Отже, чим більша група лігандів, що утворюють з даним елементом комплекси, і чим більш стійкими вони є, тим більш типовим комплексоутворювачем є цей елемент.
Низький заряд та великий радіус йонів лужних металів є причиною низької комплексоутворюючої здатності цих елементів. Для них не характерні комплекси ні з нітрогенвмісними, ні з сульфурвмісними лігандами, ні з галогенами. Їх комплекси, що утворюються при безпосередній взаємодії амоніаку з безводними солями, легко руйнуються під дією води.
Численні кристалогідрати солей лужних металів можна наближено вважати аквакомплексами.
Для легких елементів Iа групи відомі комплекси з деякими органічними лігандами, наприклад, з бензоїлацетоном:
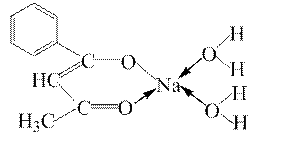
ЕДТА та деякі інші комплексони дають комплекси з Літієм. Калій і Цезій комплексів не утворюють.
Елементи Iб групи дають достатньо стійкі комплекси з галогенами, амінами, сульфурвмісними та з деякими оксигеновмісними лігандами. Для Cu+, Ag+, Au+ відомі комплекси з координаційними числами 2 і 3, наприклад: (NH4)2[CuBr3], (NH4)2[CuCl3].
Йони Cu2+, Ag2+, Au2+ координують навколо себе по чотири або шість замісників. При цьому утворюються комплекси з плоским тетраедричним або октаедричним розташуванням лігандів навколо центрального йона. Комплексні галогенопохідні Ag2+ та Au2+ невідомі, а Cu2+ нестійкі через окисно-відновну взаємодію з галогенід-іонами.
Комплекси Купруму, Аргентуму, Ауруму, що містять зв'язок метал–Нітроген мають координаційні числа 2, 4, 6. Наприклад:
[Cu(NH3)2]+, [Cu(NH3)2]2+, [CuPy6]+, [CuPy4]+, [CuPy6]2+, [Ag(NH3)2]+, [Au(NH3)4]3+ та ін.
Найбільш стійкими є комплекси [Cu(NH3)2]+, [Ag(NH3)2]+, [Cu(NH3)4]2+.
Для елементів даної групи дуже характерними є утворення зв’язків Ме–S. Дуже стійкими є комплексні ціанідні і роданідні йони.
Таблиця 1
Дата добавления: 2020-10-14; просмотров: 733;











