Розвиток теоретичних уявлень про будову комплексних сполук
У 1893р. швейцарський хімік, лауреат Нобелевської премії Альфред Вернер запропонував координаційну теорію будови комплексних сполук. Згідно з цією теорією, у кожній комплексній сполуці розрізняють центральний атом або йон, навколо якого розташовуються (координують) декілька нейтральних молекул або йонів протилежного знаку. Ці молекули або йони називаються лігандами (адендами, замісниками) і знаходяться у внутрішній координаційній сфері центрального йона-комплексоутворювача. Кількість лігандів складає координаційне число йона-комплексоутворювача.
Відомі комплекси, у яких координаційні числа можуть мати значення від 2 до 8; однак найбільш поширені комплекси з координаційними числами 6 і 4. Йони, що знаходяться у зовнішній координаційній сфері, зв’язані з комплексоутворюючим йоном лише електростатичними силами. Приклади:
| K+[BF4]– калій тетрафторборат | 4K+[Fe(CN)6]4– калій гексаціано(ІІ)ферат | [Ni(NH3)6]2+2Cl– нікол(ІІ) гексаамінохлорид |
Електричний заряд комплексного йона дорівнює різниці між зарядом центрального йона-комплексоутворювача і зарядами лігандів. Комплексними вважаються тільки такі сполуки, у яких існує хімічний зв’язок між центральний йоном і лігандами. Роль центральних атомів у комплексах можуть виконувати атоми майже всіх елементів, але найбільшу здатність до комплексоутворення мають перехідні метали. Ліганди завжди мають пару неподілених електронів.
Комплекси бувають двох типів: йонні і ковалентні.
В комплексах йонного типу ліганди зв’язані з центральним йоном за рахунок електростатичних сил притяжіння або йон-дипольних сил. Комплекси йонного типу легко розпадаються на складові частини. До таких комплексів належать деякі галогенокомплекси і більшість аквакомплексів (наприклад, [Al(H2O)6]3+, [Cr(H2O)6]3+. У даному випадку гідратовані йони металів настільки міцно зв’язують воду, що їх можна вважати комплексними йонами. У таких йонах молекули води із внутрішньої координаційної сфери можуть бути замінені йонами Cl– і іншими аніонами, в результаті чого утворюється ряд аквакомплексів. Для цих аквакомплексів характерна зміна забарвлення. Наприклад, [Cr(H2O)4Cl2]Cl∙2H2O–темно-зелений; [Cr(H2O)6]Cl3 – фіолетовий.
У ковалентних комплексах зв’язок між центральним атомом і лігандами не тільки більш міцний, але і направлений у просторі так же, як і ковалентні зв’язки в органічних сполуках. Внаслідок цього існують геометричні і оптичні ізомери таких комплексів.
Критерієм для розрізнення цих двох типів зв’язків у комплексах є відстань між центральним атомом і лігандами. Чим ця відстань більша, тим менш стійким є комплекс і відноситься він до йонного типу. Наприклад, комплекс [Co(NH3)6]Cl2 є йонного типу, а комплекс [Co(NH3)6]Cl3 – ковалентного типу, хоч їх хімічні формули дуже подібні.
Ковалентні комплекси ще називають комплексами проникнення.
У 1923р. американський фізико-хімік Г. Льюїс запропонував електронну теорію координаційного зв’язку. За цією теорією ліганд є донором, а центральний атом акцептором електронів. Пара неподілених електронів ліганду утворює координаційний зв’язок з центральним атомом. Цей зв’язок є звичайний σ-зв’язок.
Квантовомеханічна теорія доповнює і уточнює електронну теорію. Згідно цієї теорії беруться до уваги вільні і частково зайняті орбіталі центрального атома і їх взаємне перекривання з орбіталями лігандів при утворенні координаційних зв’язків, які направлені у просторі. Таким чином, квантовомеханічна теорія дає можливість передбачати просторову конфігурацію комплексу.
Через донорну природу координаційного зв’язку (ліганд"метал) від’ємний заряд центрального атома інколи сильно збільшується. Тому у тих випадках, коли ліганд може прийняти електрони, а метал має пару неподілених електронів на одній із своїх d-орбіталей, може утворюватися π-зв’язок від металу до ліганду, тобто метал зв’язується з лігандом подвійним зв’язком. Наприклад, у комплексному йоні [Fe(CN)6]4– між металом і ціанід-іоном може бути три типи зв’язків:
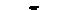
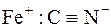
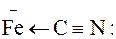
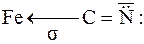
йонний зв’язок координаційний зв’язок подвійний зв’язок
У йоні [Fe(CN)6]4– три зв’язки Ферум-Карбон є координаційними, а три інші-подвійні зв’язки. У таких зв’язках бере участь одна р-орбіталь Карбону, тому вони називаються dπ–pπ-зв’язками.
Теорія поля лігандів розглядає хімічні зв’язки у комплексі з чисто електростатичної точки зору. Ліганди направлені до центрального атома своїми від’ємними зарядами (відповідно від’ємними кінцями своїх диполів) і викликають в його електронній системі збурення, які можуть бути розраховані і які дозволяють зробити висновки відносно структури і стійкості комплексів.
Дата добавления: 2020-10-14; просмотров: 624;











