Ізомерія комплексних сполук
Можуть існувати комплекси однакового якісного і кількісного складу, але з різним розташуванням груп у внутрішній і зовнішній координаційних сферах. Наприклад:
[Co(NH3)5OSO3]+Br– і [Co(NH3)5Br]2+SO42–,
Тобто ці дві комплексні сполуки є ізомерами. Такий тип ізомерії називається іонізаційною ізомерією.
Існує багато комплексів з органічними сполуками, які містять атоми О, N, S, Р та ін., зв’язані з атомами Карбону. Такі сполуки (спирти, кетони, карбонові кислоти, аміни, фосфіни та ін.) мають неподілені пари електронів у вищезгаданих атомів і утворюють з перехідними металами комплекси.
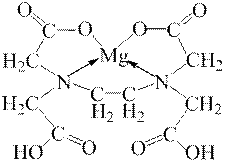
Якщо органічна сполука має дві функціональні групи, які здатні займати два координаційних місця біля центрального атома-комплексоутворювача, то такі ліганди називаються хелатними. Такими хелатними лігандами є, наприклад, оксалат-іон (–ООС–СОО–), етилендиамін (Н2N–СН2–СН2–NH2), етилендиамінтетраацетат – ЕДТА або його динатрієва сіль – Nа-ЕДТА (трилон Б).
Зокрема, трилон Б утворює хелатні структури з йонами багатьох металів, наприклад:
Велике практичне значення для аналітичної хімії має комплекс Нікола з диметилгліоксимом (реактив Чугаєва):
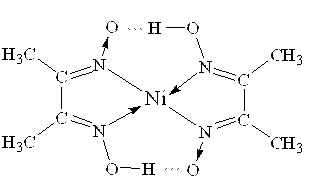
Цей малорозчинний комплекс має світло-червоне забарвлення. Реакція на йони Ni2+ дуже чутлива і специфічна, дозволяє виявляти слідові кількості нікол(ІІ)-іонів у розчині навіть у присутності великого надлишку йонів Со2+.
Просторове розташування лігандів у комплексах може бути різне. У комплексах з координаційним числом 6 ліганди займають вершини октаедра, в центрі якого знаходиться центральний атом. Октаедрична конфігурація була встановлена рентгеноструктурним методом для деяких комплексів, наприклад:
K3[Co(NO2)6], K2[PtCl6], K2[SnCl6] та ін.
У комплексах з координаційним числом 4 чотири ліганда розташовані навколо центрального атома в одній з ним площині у вершинах квадрата. Плоска конфігурація виявляється у комплексів [Pt(NH3)4]Cl2, K2[PtCl4] та ін.
У молекулі [Pt(NH3)4]Cl2 йон Pt2+ знаходиться в центрі квадрата, у вершинах якого розміщені дві молекули амоніаку і два йони Cl–. Таке розташування може бути здійснене двома способами, тому існують дві сполуки, які не переходять одна в іншу:
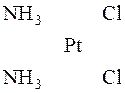
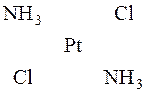
Вони мають однаковий склад, але різну будову і тому мають різні властивості.
Одна із модифікацій комплексу [Pу2Cl2Co] має тетраедричну будову. Йон Со2+ розташований у центрі тетраедра, у вершинах якого знаходяться дві молекули піридину і два йони Cl–.
У залежності від просторового розташування лігандів комплекси проявляють геометричну і оптичну ізомерію.
При симетричному (тетраедричному) розташуванні чотирьох лігандів навколо центрального йона ізомерія можлива тоді, коли всі чотири ліганди різні. Геометрична ізомерія (цис-, транс-ізомерія) проявляється лише у плоских або октаедричних комплексах.
Комплекси, побудовані за типом площин або октаедра, що містять у внутрішній координаційній сфері ліганди тільки одного типу, не утворюють геометричних ізомерів, так як всі чотири чи шість місць біля центрального атома ідентичні; заміна одного з чотирьох чи шести лігандів на якийсь інший не призводить до появи ізомерії.
Подальше заміщення лігандів на два інших дає комплекси, що можуть існувати у двох геометрично ізомерних формах, наприклад:
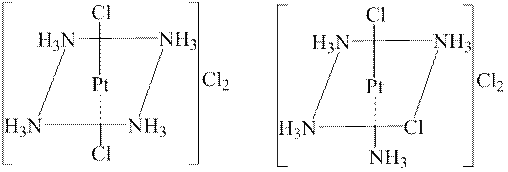
Таким чином, необхідною умовою існування геометричних ізомерів є наявність у внутрішній координаційній сфері комплексу лігандів різного типу. Такі сполуки характерні для елементів восьмої групи, Хрому, Купруму та ін.
Геометричні ізомери можуть досить суттєво відрізнятися за стійкістю і за хімічними властивостями.
Найбільш вивчені геометричні ізомери комплексних сполук Pt(ІІ), Pt(IV), Co(III), Cr(III) та ін.
Ізомерія характерна для комплексних катіонів, комплексних аніонів, сполук-неелектролітів.
Розчинність цис-ізомерів, як правило, більша розчинності транс-форми. Стійкість до нагрівання також суттєво залежить від будови геометричних ізомерів.
Спектри поглинання геометричних ізомерів відрізняються положенням смуг поглинання.
Геометричні ізомери комплексів характеризуються різними величинами дипольних моментів, pH, електропровідністю розчинів.
Деякі комплексні сполуки можуть існувати як два ізомери, один із яких по своїй конфігурації є дзеркальним відображенням іншого, причому ці дві форми не можуть бути суміщені у тривимірному просторі. Такі ізомери називаються оптичними.
Оптичні ізомери мають однакові хімічні властивості. Фізико-хімічні властивості асиметричного характеру у дзеркальних ізомерів можуть бути різними. Наприклад, оптичні ізомери мають однакову за величиною, але протилежну за знаком здатність обертати площину поляризації світлового променя, мають різні швидкості взаємодії оптичних ізомерів з молекулами оптично активного замісника.
Причиною проявлення речовиною оптичної ізомерії є відсутність у молекулі центру або площин симетрії.
Суміш рівних кількостей двох оптично активних ізомерів не обертає площину поляризації світлового променя і називається рацематом.
Відсутність центру симетрії може бути коли молекула в цілому асиметрична у результаті координування різнорідних оптично неактивних монодентатних лігандів; якщо речовина має оптично недіяльні, що мають елементи симетрії, ліганди з координаційною ємністю два і більше, то такі сполуки, що мають тільки осьову симетрію, можуть проявляти оптичну активність; якщо оптично активні ліганди мають осьову симетрію, яка співпадає з елементами симетрії комплексу, то симетрія комплексу знижуватись не буде; якщо у процесі координації оптично активних лігандів, що не мають елементів симетрії, симетрія комплексу у цілому понижується, то збільшуються можливості для проявлення оптичної активності; коли молекула ліганду не має оптичної активності, але в результаті координації один із атомів молекули ліганду стає асиметричним, то виникає оптична активність комплексу.
Для речовин, що містять у своєму складі декілька комплексних йонів, характерна координаційна ізомерія. Вона полягає у різному розподіленні лігандів у складі внутрішніх координаційних сфер цих йонів. Наприклад:
[Cu(NH3)4][PtCl4] і [CuCl4][Pt(NH3)4].
Відомі випадки, коли обидва центральні йони є йонами одного і того ж хімічного елемента. Наприклад,
[Co(NH3)6][Co(NO2)6] і [Co(NH3)4(NO2)2][Co(NH3)2(NO2)4].
Дата добавления: 2020-10-14; просмотров: 903;











