Колебательные реакции
— это периодические процессы, характеризующиеся колебаниями концентраций некоторых промежуточных соединений и соответственно скоростей превращения
Такие процессы наблюдаются в газовой и жидкой фазах, особенно часто на границе раздела этих фаз с твердой фазой.
Колебательными чаще бывают редокс-реакции и реакции, сопровождающиеся появлением новой фазы вещества. Причиной возникновения колебаний концентрации является наличие обратных связей между отдельными стадиями сложной реакции: положительных и отрицательных
Колебательные реакции представляют собой циклические процессы
В 1951 г. Б.П. Белоусов открыл колебания концентраций окисленной и восстановленной форм церия в реакции взаимодействия лимонной кислоты с броматом, катализируемой ионами церия
В конце 1961 г. А.М. Жаботинский получил колебания при использовании в качестве восстановителя в реакции Белоусова малоновой и яблочной кислот
Анатолий Маркович Жаботинский
(17 января 1938, Москва — 16 сентября 2008, Бостон) — советский и американский биофизик, физико-химик, первоисследователь механизма реакции Белоусова-Жаботинского. С 1991 по 2008 работал в университете Брандайса, штат Массачусетс
Новость об этой изумительной реакции обошла весь мир, и в нескольких лабораториях (в СССР, США и Западной Европе) стали интенсивно изучать реакцию под названием "реакция Белоусова—Жаботинского" (БЖ)
В реакции Белоусова-Жаботинского при взаимодействии ионов Ce4+ с малоновой кислотой происходит их восстановление:
Се4+ + C3H3O4 = Ce3+ + продукт (1)
Се3+ + ВгО3- → Се4+ (2)
Реакция (2) относится к автокаталитическим, и в ней самоускоряющемуся протеканию предшествует период индукции, то есть реакция включается не сразу
В реакции Белоусова-Жаботинского при взаимодействии ионов Ce4+ с малоновой кислотой происходит их восстановление:
Се4+ + C3H3O4 = Ce3+ + продукт (1)
Се3+ + ВгО3- → Се4+ (2)
Реакция (2) относится к автокаталитическим, и в ней самоускоряющемуся протеканию предшествует период индукции, то есть реакция включается не сразу
Окраска раствора, обусловленная поглощением света в видимой области спектра комплексом Се4+ с малоновой кислотой, исчезает
По завершении периода индукции происходит самоускоряющийся переход ионов Ce3+ в Ce4+ и раствор окрашивается вновь
Б. П. Белоусов уже в первых опытах заметил:
при прекращении перемешивания изменение окраски в растворе распространяется волнами:
«Колба становится похожей на зебру»
Это распространение химических колебаний в пространстве стало особенно наглядным, когда в 1970 г. А. М. Жаботинский и А. Н. Заикин налили реакционную смесь тонким слоем в чашку Петри. В чашке образуются концентрические окружности, спирали, «вихри», распространяющиеся со скоростью около 1 мм/мин
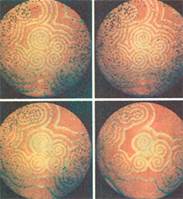
Рис.1. Распространение химических колебаний в пространстве
Периодический характер процесса можно объяснить следующим образом…
В результате реакции (1):
Ce(IV) + малоновая кислота → Ce (III) + продукт
образуются бромид-ионы, замедляющие реакцию (2):
Ce(III) + HBrO3 → Ce(IV) + продукты
Концентрация бромида зависит от скорости реакции, в которой он расходуется за счет ВгО3- + Br-→ Br2
Если концентрация бромида достаточно высока, то каталитический цикл прерывается
В целом механизм реакции БЖ может быть описан следующим набором уравнений:
Процесс А
BrO3- + 2Br- + 3CH2(COOH)2 + 3H+ → 3BrCH(COOH)2 + 3H2O
BrO3- + Br-+ 2H+→ HBrO2 + HOBr
HBrO2 + Br- + H+→ 2HOBr
HOBr + Br- + H+→ Br2 + H2O
Br2 + CH2(COOH)2→ BrCH(COOH)2 + Br- + H+
Процесс Б
BrO3- + 4Ce4+ + CH2(COOH)2 + 5H+ → BrCH(COOH)2 +
4Ce4+ + 3H2O
BrO3- + HBrO2 + H+ → 2BrO2 + H2O, BrO2 + Ce3+ + H+ →
HBrO2 + Ce4+
2HBrO2 → BrO3- + HOBr + H+
HOBr + CH2(COOH)2 → BrCH(COOH)2 + H2O
Кроме приведенных идут также реакции:
6Ce4+ + CH2(COOH)2 + 2H2O → 6Ce3+ + HCOOH + 2CO2 + 6H+,
4Ce4+ + BrCH(COOH)2 + 2H2O → Br- + 4Ce3+ + HCOOH + 2CO2 + 5H+
Дата добавления: 2016-05-30; просмотров: 1849;











