Вандерваальсовы взаимодействия
Если два каких-либо атома находятся на расстоянии 0,3-0,4 нм друг от друга, то между ними возникает неспецифическое притяжение. Такое притяжение, называемое вандерваальсовым взаимодействием, менее специфично и значительно слабее, чем электростатические взаимодействия или водородные связи, однако оно имеет не менее важное значение в биологических системах. В основе возникновения вандерваальсовых взаимодействий лежит тот факт, что распределение электронного заряда вокруг атома меняется во времени. В любой взятый момент времени распределение заряда не является полностью симметричным. Эта преходящая асимметрия электронного заряда одного атома вызывает изменение распределения электронов вокруг соседних атомов. По мере сближения двух атомов до так называемого расстояния вандерваальсова контакта сила притяжения между ними возрастает (рис. 3.1.2).
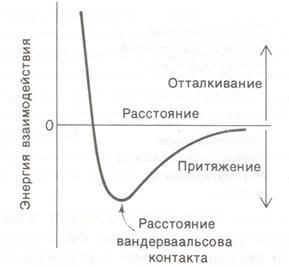
Рис. 3.1.2. Энергия связей, обусловленных вандерваальсовыми взаимодействиями, как функция расстояния между двумя атомами
На расстоянии, более коротком, чем контактное, начинают преобладать очень большие силы отталкивания, поскольку происходит перекрывание двух внешних электронных облаков. Контактное расстояние между атомами кислорода и углерода, например, составляет 0,34 нм, то есть сумму контактных радиусов атома О (0,14 нм) и С (0,2 нм).
Энергия связи двух атомов, обусловленной вандерваальсовыми взаимодействиями значительно меньше энергии водородных связей, а также связи, возникающей под влиянием электростатических сил.
Нужно отметить, что одно отдельно взятое вандерваальсово взаимодействие имеет очень небольшое значение: сила возникающей связи едва превышает среднюю тепловую энергию молекул при комнатной температуре. Вандерваальсовы взаимодействия приобретают большое значение только при одновременном сближении множества атомов субстрата с множеством атомов фермента. Эффективное вандерваальсово взаимодействие между субстратом и ферментом возможно лишь при наличии стерической комплементарности. Следовательно, хотякаждое отдельно взятое вандерваальсово взаимодействие неспецифично, специфичность возникает при одновременном образовании большого числа вандерваальсовых связей. Нужно отметить, что отталкивание, возникающее при сближении двух атомов на расстояние меньше вандерваальсова контактного, столь же необходимо для создания специфичности взаимодействия, как и притяжение.
Дата добавления: 2020-10-01; просмотров: 842;











