Электростатические взаимодействия
Заряженная группа субстрата может реагировать с группой фермента, несущей противоположный заряд. Сила такого электростатического взаимодействия определяется законом Кулона:
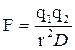
где q1 и q2 – заряды соответствующих групп, r – расстояние между ними, D-диэлектрическая постоянная среды. Электростатическое взаимодействие наиболее сильно проявляется в вакууме (где D = 1) и наиболее слабо – в такой среде, как вода (где D = 80).
Примером электростатического взаимодействия может служить связывание глицил-L-тирозина с карбоксипептидазой А – протеолитическим ферментом, который отщепляет С-концевые остатки аминокислот. Отрицательно заряженная концевая карбоксильная группа дипептидного субстрата взаимодействует с положительно заряженной гуанидиновой группой аргининового остатка на ферменте. Расстояние между этими двумя противоположно заряженными группами составляет 0,28 нм:
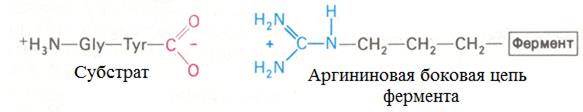
Такой тип взаимодействия называют также ионной связью, солевой связью, солевым мостиком или ионной парой. Все эти термины имеют одно и то же значение: электростатичeскoe взаимодействие между противоположно заряженными группами. Между отрицательно заряженным субстратом и положительно заряженной боковой цепью лизинового или аргининового остатка могут возникать электростатические взаимодействия. Если величины рК имидазольной группы остатка гистидина или концевой аминогруппы полипептидной цепи обеспечивают их положительный заряд при данном рН среды, то они также могут функционировать как потенциальные участки связывания отрицательно заряженного субстрата. В случае если субстрат имеет положительный заряд, потенциальными участками связывания служат отрицательно заряженные карбоксильные группы аспартата и глутамата, а также концевая карбоксильная группа полипептидной цепи.
Водородные связи
Несмотря на то, что многие субстраты не имеют заряда, они связываются с ферментами с высокой степенью специфичности и сродства. Основной вид взаимодействия таких субстратов, а также большинства заряженных субстратов с ферментами – это образование водородных связей. В водородной связи атом водорода связан сразу с двумя другими атомами. Тот атом, с которым водород связан более прочно, называют донором водорода, тогда как второй атом – акцептором водорода. По существу водородную связь можно рассматривать как промежуточное взаимодействие, возникающее при переносе протона от кислоты к основанию. Атом-акцептор должен иметь частичный отрицательный заряд, который и притягивает водород.
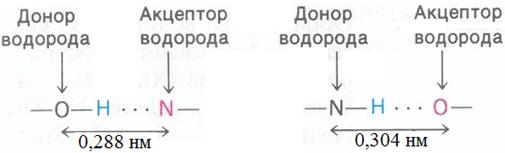
При образовании водородных связей в биологических системах атомами-донорами служат атомы азота или кислорода, ковалентно связанные с атомом водорода. Роль атомов-акцепторов выполняют кислород или азот. Типы водородных связей и их длины приведены в табл. 3.1.2. Энергия связей колеблется от примерно 3 до 7 ккал/моль.
Таблица 3.1.2
Типичные размеры водородных связей
| Связь | Длина, нм |
| О – Н …О | 0,270нм |
| О – Н …О─ | 0,263нм |
| О – Н … N | 0,288нм |
| N – H … O | 0,304нм |
| N+ – H … O | 0,293нм |
| N – H … N | 0,310нм |
Водородные связи прочнее, чем связи, обусловленные вандерваальсовыми взаимодействиями, но значительно слабее, чем ковалентные связи. Важная особенность водородных связей состоит в том, что их энергия зависит от геометрии. Водородная связь оказывается наиболее сильной, если донор, водород и акцептор лежат на одной прямой. Если же атом-акцептор расположен под углом по отношению к линии, соединяющей атом-донор и водород, то связь будет тем слабее, чем больше этот угол:

Роль водородных связей во взаимодействии субстрата с ферментом хорошо видна на примере связывания уридинсодержащей части субстрата с панкреатической рибонуклеазой – ферментом, расщепляющим рибонуклеиновую кислоту (рис. 3.1.1).
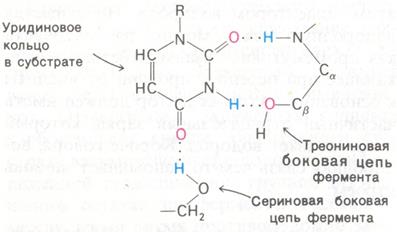
Рис. 3.1.1. Образование водородных связей при связывании субстрата рибонуклеазой
В этом случае образуются три водородные связи:
1. Одна из С=О-групп уридинового кольца соединена водородной связью с N-Н-группой пептидной цепи;
2. N–Н-группа уридинового кольца соединена водородной связью с
–ОН-группой остатка треонина;
3. Другая С=О-группа уридинового кольца соединена водородной связью с –ОН-группой остатка серина.
Дата добавления: 2020-10-01; просмотров: 648;











