Влияние температуры и катализаторов на скорость химических реакций
Повышение температуры ускоряет большинство химических реакций. Приближенно влияние температуры на скорость реакции описывает эмпирическое правило Вант-Гоффа: при повышении температуры на 10 К скорость большинства реакций увеличивается в 2¸4 раза
u2 = u1× 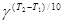 ,
,
где u1, u2 – скорости реакции при температурах Т1 и Т2; g - температурный коэффициент Вант-Гоффа, который показывает во сколько раз увеличивается скорость реакции при повышении температуры на 10 К.
Для многих реакций в интервале температур от комнатных значений до 400 °С температурный коэффициент лежит в пределах от 2 до 4. Точнее значение g можно вычислить по формуле
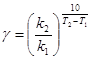 ,
,
где k1, k2 – константы скорости реакции при температурах Т1 и Т2.
Более строгая зависимость скорости реакции от температуры описывается уравнением Аррениуса
k =k0× 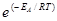 ,
,
где k – константа скорости реакции при температуре Т; k0 – предэкспоненциальный множитель; е – основание натурального логарифма; ЕА – энергия активации, Дж/моль; R – универсальная газовая постоянная.
Энергией активации называют избыток энергии, которым должны обладать молекулы, по сравнению со средним значением энергии частиц в системе, чтобы их столкновение привело к образованию продуктов реакции. Величина энергии активации зависит от природы реагирующих веществ. Для химических реакций значения ЕА лежат в пределах 40¸400 кДж/моль. В узком интервале температур энергия активации практически не зависит от температуры и может быть вычислена по формуле
ЕА = 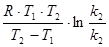 ,
,
где Т1, Т2 – абсолютные значения температур, К; k1, k2 – значения констант скоростей реакции при данных температурах.
Для ускорения очень медленно протекающих химических реакций применяют катализаторы – вещества, способные понижать энергию активации реакции, ослабляя связи между молекулами. При этом молекулы становятся реакционно-способными при более низких температурах. Изменение скорости реакции путем добавления небольших порций катализатора называют катализом. Увеличение скорости реакции в присутствии катализатора можно оценить по уравнению
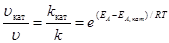 ,
,
где uкат, kкат – скорость и константа скорости реакции в присутствии катализатора; u, k –скорость и константа скорости реакции без катализатора; ЕА, кат, ЕА – энергия активации реакции в присутствии катализатора и без него.
Пример 1.При 150 °С реакция заканчивается за 16 минут. Определите время, необходимое для протекания реакции при 200 °С, если температурный коэффициент Вант-Гоффа равен 2,5.
Р е ш е н и е
Между скоростью протекания химической реакции и ее продолжитель-ностью существует обратно пропорциональная зависимость
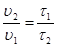 ,
,
тогда правило Вант-Гоффа в данном случае можно записать в виде
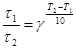 , откуда
, откуда 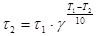
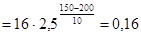 мин.
мин.
Пример 2.Вычислите энергию активации реакции, если при повышении температуры от 290 К до 300 К скорость реакции увеличивается в 2 раза.
Р е ш е н и е
Согласно основному закону химической кинетики, скорость реакции и константа скорости реакции прямо пропорциональны друг другу, то есть выполняется соотношение
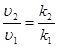
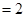 .
.
Подставим это в формулу для расчета энергии активации
ЕА = 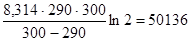 Дж/моль.
Дж/моль.
Пример 3. Определите, на какую величину произошло снижение энергии активации при введении в систему катализатора, если при температуре 450 К в присутствии катализатора скорость реакции увеличилась в 1000 раз.
Р е ш е н и е
Преобразуем уравнение 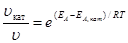 к виду
к виду
(ЕА, кат – ЕА) = R×T×ln 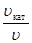 .
.
По условию задачи 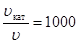 , тогда
, тогда
(ЕА, кат – ЕА) = 8,314 × 450 × ln1000 = 25844 Дж/моль.
Дата добавления: 2018-11-26; просмотров: 1458;











