Никотинамидные кофакторы
Большое число дегидрогеназ, катализирующих важные процессы метаболизма в живом организме, содержат в качестве кофермента никотинамидные кофакторы. К числу пиридинзависимых дегидрогеназ относится около 200 ферментов, которые катализируют восстановление NAD и NADР различными органическими субстратами. Большая часть из них является NAD-зависимыми, сто – NADР-зависимыми и около 50-ти дегидрогеназ специфичных и к NAD и к NADР. В большинстве клеток (исключение составляют клетки листьев растений) NAD присутствует в значительно больших количествах, чем NADН, то есть окисленной формы всегда больше, чем восстановленной (NAD+/NADН = 2-4). В отношении фосфорилированной формы никотиновых кофакторов отмечают, что NADРН всегда больше, чем NADР, то есть восстановленной формы всегда больше, чем окисленной (NADР+/NADРН <1). В листьях растений концентрация NAD, NADН, NADР и NADРН примерно одинакова.
При участии NAD и NADР-зависимых дегидрогеназ осуществляются обратимые реакции дегидрирования спиртов, оксикислот и некоторых аминокислот с образованием альдегидов, кетонов, и кетокислот. В общем виде эти реакции можно изобразить следующим образом:
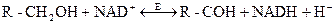
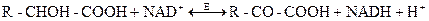
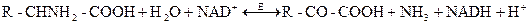
В большинстве случаев NAD-зависимые процессы могут быть и NADР-зависимыми. К NAD(Р)-зависимым дегидрогеназам относятся, например, лактатдегидрогеназа, глюкозо-6-фосфатдегидрогеназа, глицеральдегид-3-фосфатдегидрогеназа и др.
Никотинамидные кофакторы впервые были идентифицированы О. Варбургом в 1935 году. Молекула NAD состоит из двух гетероциклов – пиридинового и аденинового, соединенных цепочкой из двух остатков рибозы и остатка пирофосфорной кислоты (рис. 1.4.2). Остатки D-рибозы соединяют атом азота аденина и атом азота никотинамида гликозидной связью.
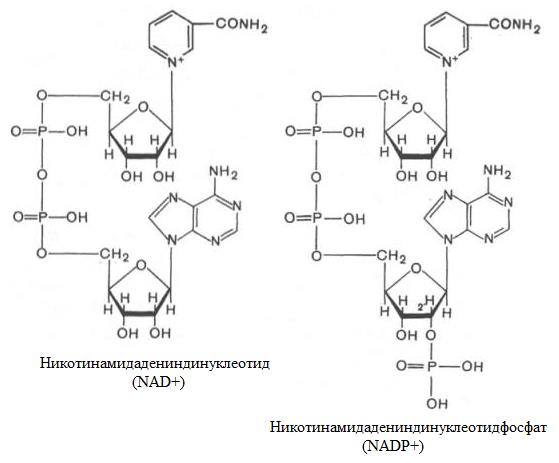
Рис. 1.4.2. Структура NAD+ и NADР+
При физиологических значениях рН заряд всей молекулы равен «-1», так как один отрицательный заряд остатка пирофосфорной кислоты нейтрализуется положительным зарядом на атоме азота в никотинамидном кольце. В молекуле NADР появляются дополнительные ионизированные группировки, поэтому, при физиологических значениях рН суммарный заряд молекулы NADР равен «-3».
В водных растворах NAD и NADР проявляют слабокислые свойства. NAD является полифункциональной молекулой, содержащей катионные и анионные группы. Остатки рибозы и пирофосфатная группа сообщают ей ярко выраженный полярный характер, в то время как пиридиновый и пуриновый циклы гидрофобны. Вследствие такого разнообразия свойств молекула NAD взаимодействует не только с большим числом апоферментов, но и с различными низкомолекулярными соединениями.
NAD и NADР играют ключевую роль в биологическом окислении, участвуя в окислительно-восстановительных реакциях. Эти ферменты осуществляют отщепление двух эквивалентов водорода. Отщепляется так называемый гидрид-ион (водород с ионной парой Н¯). При этом кольцо разрывается, теряет ароматическую природу и становится хеноидным. Оставшийся протон водорода уходит в среду:
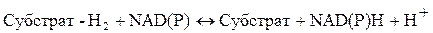
Таким образом NADН – это 1,4 дигидроникатинамидадениндинуклеотид. Рабочей частью молекулы NAD и NADР является никотинамидное кольцо (рис. 1.4.3).
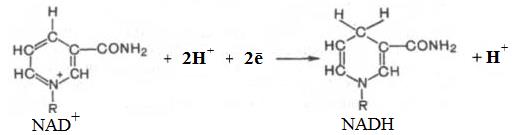
Рис. 1.4.3. Рабочая часть молекулы никотинамидного кофактора
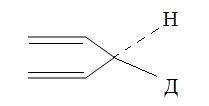
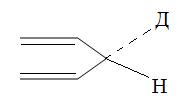
Установлено, что передача атома водорода от субстрата к NAD и NADР происходит непосредственно, то есть без обмена протона с водной средой. Присоединение водорода происходит стереоспецифически, то есть для данного фермента всегда по одну сторону пиридинового ядра. В зависимости от направления присоединения водорода все никотинамидные дегидрогеназы делят на А и В тип (рис. 1.4.4).
| 
|
| А тип | В тип |
Рис. 1.4.4. Типы присоединения водорода к пиридиновому ядру молекулы никотинамидного кофактора
К дегидрогеназам А типа относят дегидрогеназы спиртов, L-лактата, L-малата, D-глицерата. К дегидрогеназам В типа относят дегидрогеназу L-глутамата, D-глюкозы, D-глицеральдегид-3-фосфата.
NAD и NADН отличаются друг от друга по оптическим свойствам (рис. 1.4.5).
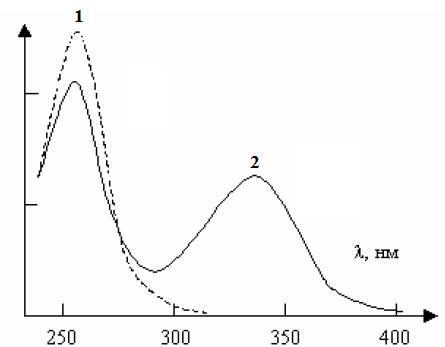
Рис. 1.4.5. Спектры поглощении NAD+ (1) и NADН (2)
Пик при 260 нм обусловлен наличием аденина, поэтому поглощают обе формы никотиновых кофакторов. Дополнительный пик при 340 нм появляется только для NADН, что обусловлено перестройкой пиридинового цикла, то есть в цикле исчезает одна двойная связь и кольцо приобретает хеноидный характер.
Стабильность окисленной и восстановленной форм никотинамидных коферментов меняется в зависимости от рН среды по-разному: восстановленная форма нестойка в кислых растворах, но устойчива в щелочных. Окисленная форма наоборот нестойка в щелочных растворах, но устойчива в кислых. В нейтральных растворах восстановленная форма менее стабильна, чем окисленная.
Показано, что в связывании кофактора с апобелком могут принимать участие NH2 группы как пиридинового, так и никотинамидного колец. Важное значение имеет гидрофобный характер пиридинового кольца и отрицательно заряженная пирофосфатная группировка, поскольку для большинства NAD и NADР-зависимых дегидрогеназ показано наличие в активном центре катионных участков, взаимодействующих при связывании с остатками фосфорной кислоты.
Дата добавления: 2020-10-01; просмотров: 737;











