Манометрический, биолюминесцентный и др.
Колориметрические (фотометрические) методы. В основе этих методов лежит измерение при помощи визуального или фотоэлектрического колориметра окрашенного продукта, образующегося при взаимодействии субстрата или продукта действия фермента со специфическими реактивами, которые обычно добавляются в фиксированную опытную пробу, взятую после остановки ферментативной реакции. Эти методы весьма разнообразны.
Спектрофотометрические методы. Основаны на поглощении света в определенных участках спектра многими соединениями, являющимися активными группами ферментов, субстратами или продуктами реакции. Положение максимума поглощения при определенной длине волны определяется наличием в исследуемом материале определенных групп – аналитических форм. Для измерения спектров используют специальные приборы – спектрофотометры, фотометрические абсорбциометры и др. Этот метод отличается высокой чувствительностью, быстротой определения, малым расходованием фермента и реактивов и позволяет следить за течением реакции во времени. Для этого реакционную смесь помещают в кювету, вставленную в термостатируемый кюветодержатель. Через малый промежуток времени после добавления фермента (или субстрата) и быстрого перемешивания измеряют поглощение при длине волны, характерной для используемого субстрата или конечного продукта, образующегося в данной реакции.
Для целей определения активности ферментов могут быть использованы не только измерение поглощения света, но также измерения флюоресценции – флуориметрические методы. Такое определение активности фермента в ряде случаев по чувствительности превосходит спектрофотометрические методы на целый порядок величины. Некоторые коферменты и субстраты обладают сильной флюоресценцией. NAD+ и NADP+ в восстановленном состоянии имеют сильную флуоресценцию и не флуоресцируют в окисленном состоянии. Поэтому флуорометрию используют для изучения кинетики и механизма действия никотинамидных и флавиновых ферментов.
Активность широкого спектра ферментов можно определять с помощью биолюминесцентного метода. Биолюминесценция – процесс свечения живых организмов, связанный с процессами их жизнедеятельности, и происходящий почти без выделения тепла. В основе лежит катализируемая специфическим ферментом реакция светоизлучения. Для всех биолюминесцентных систем характерен высокий квантовый выход: от 0.01 до 1, свечение их необычайно яркое. Это объясняется тем, что практически каждая молекула продукта реакции образуется в электронно-возбужденном состоянии.
Механизм реакций, сопровождающихся выделением света, весьма различен у разных видов; однако обычно включает в себя окисление низкомолекулярного субстрата, называемого люциферином, в присутствии фермента люциферазы (А). Место люциферазы у некоторых организмов занимает фотопротеин (В). Люцифераза (или фотопротеин) играет роль катализатора или матрицы, на которой протекает высокоспецифичное окисление молекулы люциферина в электронно-возбужденный продукт.
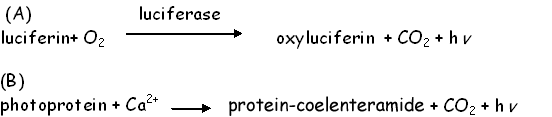
Реакция А типична для большинства известных люциферин-люциферазных систем, хотя у бактерий она не сопровождается выделением углекислого газа. Фотопротеиновым типом биолюминесценции (В) обладают около 30 видов морских кишечнополостных. Специфические Ca2+- активируемые фотопротеины (~ 22 кДа) генерируют кванты света, с максимумом люминесценции при 480 нм. В механизме окисления люциферина рачков Cypridina участвует кислород воздуха, привнося один атом в продукт реакции СО2. Хорошо изучены акворин (мономер 35 кДа) и обелин, выделенные из медуз Aequorea и гидроидного полипа Obelia, соответственно. Фотопротеины представляют собой фермент-субстратный комплекс белка и люциферина (целентеразина) с кислородом, находящийся в неактивном состоянии. Реакция светоизлучения здесь не требует присутствия каких-либо кофакторов и органических субстратов, а инициируется ионами кальция.
Все известные биолюминесцентные системы содержат от трех до шести компонентов. Кроме уже перечисленных, в процессе могут участвовать специфические кофакторы, катионы, а также переизлучатель (молекула, поглощающая энергию электронно-возбужденного состояния и преобразующая ее в свет более низкой частоты). Известно около 30 разновидностей биолюминесцентных систем, из них более-менее детально изучены менее десяти, для шести типов организмов уже сиквенирован ген люциферазы (фотопротеина).
Перспективность применения биолюминесценции определяется тем, что, во-первых, конечным продуктом люциферазной реакции является свет, который легко и с большой точностью измеряется при помощи современной электронно-оптической техники. В связи с этим, биолюминесцентные реакции чрезвычайно чувствительны. Пределы обнаружения ATP и NADH составляют соответственно 10-17 и 10-19 моль/л. Биолюминесцентный метод анализа NADH обладает в 25000 раз более высокой чувстительностью по сравнению со спектрофотометрией. Во-вторых, в основе светоизлучения лежат ферментативные реакции, что определяет высокую специфичность метода. В-третьих, около 20% всех известных ферментов являются ATP- и NAD(P)-зависимыми. Это позволяет определять концентрацию различных метаболитов и широкого спектра ферментов, характеризующих самые разные метаболические процессы. В-четвертых, эспрессность и высокая чувствительность метода позволяет проводить исследования в микрообразцах биологического материала с минимальным количеством реактивов.
Манометрические методы. Эти методы используются при определении активности фермента в тех случаях, когда в исследуемых реакциях один из компонентов находится в газообразном состоянии. К таким реакциям относится главным образом те, которые связаны с процессами окисления и декарбоксилирования, сопровождающимися поглощением или выделением кислорода и углекислоты, а также реакции, в которых выделение или связывание газа происходит в результате взаимодействия продуктов ферментативного превращения с добавленным в систему реактивом. Наблюдение за ходом реакции во времени проводится в специальных приборах - манометрических аппаратах Варбурга.
Электродные методы. Использование стеклянного электрода дает в руки исследователя другой метод изучения тех реакций, в результате которых образуется кислота. Наиболее простым приемом является регистрация изменений рН в ходе реакции, однако против него имеются два возражения. Во-первых, изменение рН в холе реакции может, вероятно, вызывать осложнения, связанные с изменением активности фермента. Во-вторых, скорость изменения рН зависит не только от скорости реакции, но также и от буферной емкости раствора. Последнее обстоятельство представляет серьезное затруднение, так как белки обладают высокой буферной емкостью. Неочищенные же препараты фермента содержат значительное количество неактивного белка, который удаляется в ходе очистки, в результате чего изменяется буферная емкость изучаемых препаратов.
Значительно большими преимуществами обладает метод непрерывного титрования. В этом случае с помощью частых добавлений небольших количеств щелочи поддерживают приблизительно постоянный уровень рН; скорость добавления щелочи отражает скорость реакции и не зависит от количества буфера. Количество буфера влияет, однако, на точность метода; если буфера берут слишком мало, то трудно поддерживать рН на постоянном уровне, если же его берут слишком много, то метод становится нечувствительным. Имеются очень удобные автоматические приборы (рН-статы), в которых поддерживается постоянное значение рН за счет непрерывного добавления кислоты или щелочи и в то же время вычерчивается кривая, показывающая количество дсь давленного реактива во времени.
Реакции, в которых участвует О2, удобно изучать полярографическим методом. Сила тока, проходящего через поляризованный платиновый электрод, зависит от концентрации О2 в растворе, в который погружен электрод, и при непрерывном измерении можно получать кривую, показывающую изменение концентрации О2. Для этой цели используют кислородные электроды двух типов: вибрирующий платиновый электрод, погруженным непосредственно в реакционную смесь, и электрод Кларка, отделенный от реакционной смеси полиэтиленовой мембраной, через которую способен диффундировать молекулярный кислород. Полярографический метод отличается от манометрического тем, что жидкость находится в закрытой системе без газовой фазы.
Исследование окислительных ферментов, которые не взаимодействуют с О2, нередко удается осуществить при добавлении к системе подходящего акцептора водорода и измерении его окислительно-восстановительного потенциала с помощью гладкого платинового электрода, потенциал которого зависит от отношения концентраций восстановленной и окисленной форм акцептора. Восстановление акцептора прослеживается по изменению потенциала электрода.
Поляриметрические методы. Многие ферменты действуют только на один из оптических изомеров своих субстратов. Если, как это часто имеет место, продукт реакции оптически неактивен, то за ходом реакции следят по изменению оптического вращения. С аналогичным положением сталкиваются и в том случае, когда субстрат оптически неактивен, но в ходе реакции образуется оптически активный продукт или когда и субстрат, и продукт оптически активны, но значительно различаются по величине удельного вращения. Этот метод, хотя и не столь удобный, как другие, все же может быть использован при изучении ряда ферментов, по отношению к которым другие методы неприменимы, особенно при изучении ферментов, действующих на углеводы. Классическим примером может служить b-фруктофуранозидаза (КФ 3.2.1.26). При работе поляриметрическим методом опыты проводят в термостатированной поляриметрической трубке.
Дата добавления: 2020-10-01; просмотров: 673;











