Тепловая денатурация
На начальном этапе очистки для разделения белков иногда используют тепловую обработку. Она эффективна, если белок относительно устойчив в условиях нагревания, в то время как сопутствующие белки денатурируют. При этом варьируют рН раствора, продолжительность обработки и температуру.
После проведения первых этапов очистки белки в экстракте отличаются друг от друга растворимостью, молекулярной массой, величиной суммарного заряда молекулы, относительной стабильностью и т.д. Эти различия используют для дальнейшего разделения белков.
Осаждение белков
Классическим методом разделения белков является метод их разделения на основе различной растворимости. Для осаждения необходимо понизить каким-либо способом растворимость белка. В целом растворимость белков зависит от их способности к гидратации. У глобулярных водорастворимых белков высокий уровень гидратации обеспечивается расположением гидрофильных групп на поверхности. Добавление органических растворителей понижает степень гидратации и приводит к осаждению белка. Принцип такого метода заключается в том, что по мере возрастания концентрации органического растворителя снижается способность воды к сольватации заряженных гидрофильных молекул фермента. Происходит снижение растворимости белков до уровня, при котором начинается их агрегация и осаждение. Важным параметром, влияющим на осаждение, является размер молекулы белка. Чем больше молекула белка, тем ниже концентрация органического растворителя, вызывающая осаждение белка.
Осаждают белки также с помощью солей, например, сульфата аммония. Этот способ называют высаливанием. Высаливание при добавлении необходимого количества соли – эффективный способ концентрирования. Принцип этого метода основан на том, что при повышении концентрации соли в растворе происходит сжатие ионных частиц, образуемых противоионами белка, что способствует сближению их до критического расстояния, на котором межмолекулярные силы ван-дер-ваальсова притяжения перевешивают кулоновские силы отталкивания противоионов. Это приводит к слипанию белковых частиц и их выпадению в осадок.
Для выделения белков применяют также метод изоэлектрического осаждения. Заряд белков обусловлен в первую очередь остатками аспаратата и глутамата (отрицательный заряд) и остатками лизина и аргинина (положительный заряд). По мере повышения рН различными способами заряд белков изменяется от положительных до отрицательных значений и в изоэлектрической точке оказывается равен нулю, вследствие чего белок лишается своей ионной атмосферы и его частицы слипаются, выпадая в осадок.
Выпавший осадок белка отделяют фильтрацией или центрифугированием. Частицы осажденного вещества под действием центробежной силы оседают на дне центрифужных стаканов и сжимаются в плотный осадок. Скоростные центрифуги (ультрацентрифуги) создают центробежное ускорение порядка 100000g, что позволяет осаждать крупные надмолекулярные агрегаты – рибосомы и вирусы.
Гель-фильтрация
С помощью метода гельфильтрации можно быстро разделить белки в соответствии с их размерами. Носителем для хроматографии является гель, который состоит из поперечно-сшитой трехмерной молекулярной сетки, сформированной в виде гранул. Чем больше поперечных сшивок, тем меньше размеры отверстий. Гель играет роль молекулярного сита. При пропускании раствора через колонку, наполненную гранулами сефадекса, крупные частицы, размер которых превышает размер пор сефадекса, будут двигаться быстро. Мелкие молекулы будут двигаться медленно, поскольку в процессе движения будут проникать внутрь гранул (рис. 1.2.3).
|
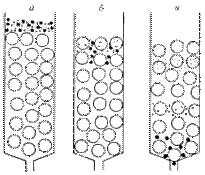
Рис. 1.2.3. Схема разделения белков методом гель-фильтрации. а – начало разделения, б – разделение, в – конец разделения. Большие кружки – частицы геля, большие точки – молекулы белков с большой молекулярной массой, маленькие точки – молекулы белков с меньшей молекулярной массой.
Дата добавления: 2020-10-01; просмотров: 659;











