Расчет ферментативной активности при определении по конечной точке и при кинетическом определении
В биохимии фотометрические измерения в большинстве случаев проводятся непосредственно при протекании биохимических реакций, в процессе которых потребляются субстраты, повышается концентрация продуктов реакций или меняются кофакторы реакций. Одним из самых распространенным оптических тестов является тест Варбурга, основанный на том, что один из продуктов дегидрогеназной реакции – восстановленная форма никотинамидадениндинуклеотид или его фосфат (NADH или NADPH) – имеет максимум поглощения при длине волны 340 нм, а их окисленные формы при этой длине волны практически не поглощают (рис. 1.1.1).
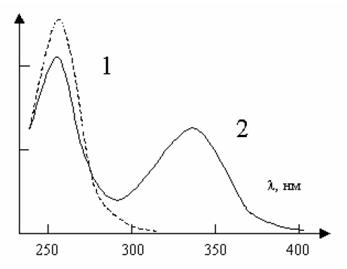 |
Рис. 1.1.1. Спектры поглощении NAD+ (1) и NADН (2). Восстановление NAD+ до NADН прослеживается при 340 нм – максимуме поглощения NADН, при котором NAD+ не поглощает
Тест может быть использован для определения скоростей тех реакций, в которых не участвуют NAD+ или NADP+, но образующиеся продукты посредством других ферментативных реакций приводят к окислению NADH или восстановлению NAD+ (непрямой оптический тест Варбурга). При кинетическом определении вычисляют изменение поглощения за 1 мин и рассчитывают активность по формуле:
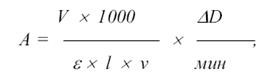 |

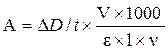 , где
, где
А – активность фермента, измеряемая в международных единицах (МЕ или Ед или U). Каталитическая активность фермента выр  ажается числом единиц, рассчитанных для 1 литра биологической жидкости (Ед/л).
ажается числом единиц, рассчитанных для 1 литра биологической жидкости (Ед/л).
V – объем реакционной смеси, мл;
1000 – коэффициент перерасчета миллимоль в микромоль;
l – длина оптического пути (1 см)
e – миллимолярный показатель поглощения NADH в реакции 6,22 л/(ммоль ´ см);
n – объем пробы (сыворотки крови или другого материала), мл;
DD/t – изменение оптической плотности за 1 мин.
Реакция, сопровождающаяся изменением фотометрического сигнала, развивается за некоторый период времени и достигает определенного конечного состояния, так называемой конечной точки. Изменение сигнала, как функция времени, представлено на рис. 1.1.2.
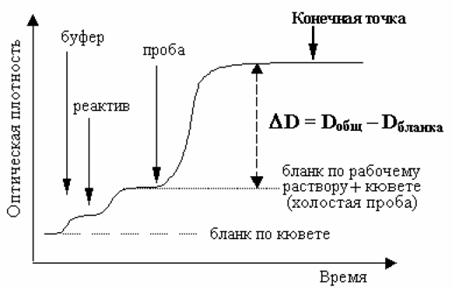 |
Рис. 1.1.2. Измерение по конечной точке. Стрелками показаны моменты внесения буфера, реактива и биологической пробы
При измерении по конечной точке уровень сигнала соответствует количеству продуктов реакции в инкубационной среде после фиксированного времени инкубации. Поглощение измеряется после окончания реакции при стабильном значении сигнала.
Существует несколько схем измерения по конечной точке.
При работе на 2-х лучевом фотометре измерение ведется в режиме сравнения растворов в двух кюветах. В каждую кюветы вносится одинаковое количество реактива, затем в 1 кювету вносится с биопроба с известной концентрацией и получают стандартный раствор с известной концентрацией исследуемого вещества, а в другую кювету помещают количество воды или физиологического раствора, равное количеству биопробы, и получают таким образом опорный раствор (бланк).
Двухлучевая схема фотометрирования предусматривает автоматическое вычитание бланка, при этом фотоэлектрический сигнал бланка (оптическая плотность) принимается за нулевой отсчет оптической плотности, относительно которой и проводится 1-точечное измерение. Пример изменения сигнала при построении калибровочной кривой при измерении по конечной точке представлен на рис. 1.1.3. Измерение проводится по методу 1-точечного измерения (1 -point assay).
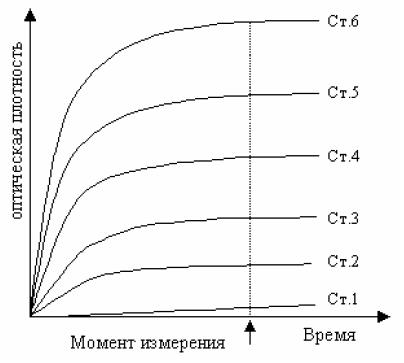
Рис. 1.1.3. 1-Точечное измерение. Сигнал развивается как функция времени для 6 стандартов. Исходная точка – нуль. Концентрация каждого стандарта измеряется 1 раз по конечной точке (по достижении стационарного уровня)
Кинетическое измерение подразумевает определение меняющейся в ходе реакции оптической плотности. Наиболее широко кинетическое измерение используется для определения активности ферментов, хотя в последнее время разработано достаточно много методов определения концентрации субстратов в период кинетического протекания реакций. Кинетическое измерение требует, наряду с соответствующим фотометрическим оборудованием, также точного поддержания температуры в измерительной кювете и правильного отсчета временных интервалов. Так, общепринятым считается поддержание температуры в измерительной ячейке в пределах ± 0,2° С. Эти условия являются обязательными для кинетических методов и доступны только при использовании современных фотометров и биохимических анализаторов. Что касается абсолютного значения температуры, то для определения активности ферментов используются 25°С, 30°С и 37°С. Температура 25°С является стандартной в физической химии, поэтому эта температура была предложена Комиссией по ферментам международного Союза по ферментам в 1961 г. В 1964 г. было предложено использовать 30°С, что связано с климатическими особенностями ряда стран и мнением о наибольшей стабильности результатов по определению активности ферментов при этой температуре. Однако в настоящее время большинство измерений в биохимических анализаторах проводится при 37°С.
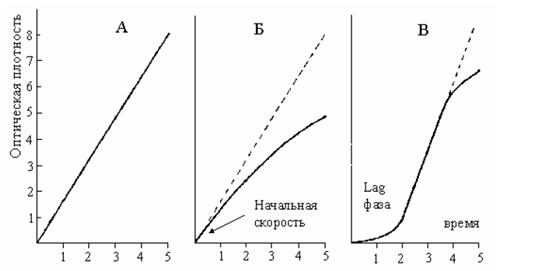 Протекание кинетических реакций неоднозначное. На рис. 1.1.4 представлены типичные варианты протекания кинетических реакций. Существует несколько схем кинетического измерения.
Протекание кинетических реакций неоднозначное. На рис. 1.1.4 представлены типичные варианты протекания кинетических реакций. Существует несколько схем кинетического измерения.
Рис. 1.1.4. Скорость ферментативной реакции как функция времени. А – скорость постоянна в течение всего периода измерения, в любой период можно по скорости реакции оценивать активность фермента; Б – скорость реакции постоянно снижается, рекомендуется активность фермента оценивать по начальной скорости; В – линейный участок, в течение которого рекомендуется определять активность фермента, устанавливается в середине периода инкубации
В случае постоянной скорости кинетической реакции (рис. 1.1.4, А) измерение можно проводить на любом отрезке линейной кривой, приводя измерение поглощения к I минуте. Расчет ведут по формуле:
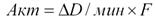 |
Достоинством данного способа является простота, возможность измерения без использования стандарта, а также независимость в пределах линейного диапазона плотностей от влияний системных интерферирующих факторов. Кинетический способ измерения допустим при использовании вымытых пластиковых кювет, которые предназначены для разового использования в биохимических анализаторах, так как оптическая плотность меняется на определенное значение в любой промежуток времени и не зависит от величины оптической плотности холостой пробы. Однако необходимо убедиться, что измерение проводится в линейном диапазоне протекания кинетической реакции.
Двухточечное измерение потенциально включает возможность нескольких методических ошибок. Если реакция начинается с очень высокой скоростью, то она может замедлиться или вообще прекратиться из-за потребления всего количества субстрата. Выявить такую погрешность при 2-х точечном измерении не представляется возможным. На ошибку указывает несоответствие результатов биохимического исследования клиническим данным. Реакция вообще может иметь нелинейный характер.
Реакция может задержаться на старте (Lag фаза в мультиферментных тестах, рис. 1.1.4, В). Наличие Lag фазы, как правило, объясняют выравниванием температуры и задержкой для равномерного перемешивания пробы с реактивом, однако основное значение имеет, по-видимому, задержка для образования комплекса субстрата [S] с ферментом [Е], поэтому Lag фаза может продолжаться до нескольких минут. При кинетических исследованиях существенное значение имеет порядок внесения реактивов. Считается правильным для лучшего перемешивания реактив большего объема добавлять к меньшему объему, в измерительную кювету сначала вносится биопроба (меньший объем), а затем рабочий реактив (больший объем), то есть, стартуют реактивом.
В биохимии для измерений, в которых регистрируется более 2 точек, принят термин “кинетическое” измерение, хотя 2-х точечное измерение также кинетическое. Непрерывное (многоточечное) измерение оптической плотности в ходе реакции позволяет оценивать характер кинетики и выбирать для расчетов линейный участок кривой. Многократное измерение прироста концентрации продукта реакции (снижения субстрата, либо изменения состояния кофермента) считается наиболее точным методом определения активности ферментов. Изменение оптического поглощения в этом случае должно быть одинаковым за равные промежутки времени (допуск отклонений от линейности не должен превышать 10 %).
ЛЕКЦИЯ 1.2
Дата добавления: 2020-10-01; просмотров: 697;











