Основные положения молекулярно-кинетической теории газов
1. Количество вещества однородного газа (в молях):
n = 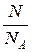 или n =
или n =  ,
,
где N – число молекул газа; NA – число Авогадро; m – масса газа; m – молярная масса газа.
Если система представляет смесь нескольких газов, то количество вещества системы равно:
n = n1+n2+...+nn = 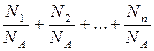
или
n = 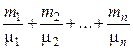 ,
,
где ni, Ni, mi, mi – соответственно количество вещества, число молекул, масса, молярная масса i-й компоненты смеси.
2. Уравнение Менделеева-Клапейрона (уравнение состояния идеального газа):
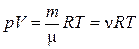 ,
,
где m – масса газа; m – молярная масса газа; R – универсальная газовая постоянная; n= m/m – количество вещества; T – термодинамическая температура Кельвина.
3. Опытные газовые законы, являющиеся частными случаями уравнения Менделеева-Клапейрона для изопроцессов:
а) закон Бойля-Мариотта (изотермический процесс: T = const;
m = const):
pV = const
или для двух состояний газа:
p1V1 = p2V2,
где p1 и V1 – давление и объем газа в начальном состоянии; p2 и V2 – те же величины в конечном состоянии;
б) закон Шарля (изобарический процесс: p = const, m = const):

или для двух состояний:

где V1 и T1 – объем и температура газа в начальном состоянии; V2 и T2 – те же величины в конечном состоянии;
в) закон Гей-Люссака (изохорический процесс – V = const,
m = const):

или для двух состояний:

где p1 и T1 – давление и температура газа в начальном состоянии; p2 и T2 – те же величины в конечном состоянии;
г) объединенный газовый закон (m = const):

или для двух состояний:
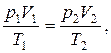
где p1, V1, T1 – давление, объем и температура газа в начальном состоянии; p2, V2, T2 – те же величины в конечном состоянии.
4. Закон Дальтона, определяющий давление смеси газов:
p = p1 + p2 +...+ pn,
где pi – парциальные давления компонентов смеси; n – число компонентов смеси.
5. Молярная масса смеси газов:

где mi – масса i-го компонента смеси; ni = mi/mi – количество вещества i-го компонента смеси; n – число компонентов смеси.
6. Массовая доля wi i-го компонента смеси газа (в долях единицы или процентах):
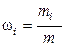 ,
,
где m – масса смеси.
7. Концентрация молекул (число молекул в единице объема):
 ,
,
где N – число молекул, содержащихся в данной системе; r – плотность вещества. Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
8. Основное уравнение молекулярно-кинетической теории газов:
 náЕпостñ,
náЕпостñ,
где áЕпостñ – средняя кинетическая энергия поступательного движения молекулы.
9. Средняя кинетическая энергия поступательного движения молекулы:
áЕпостñ =  kT,
kT,
где k – постоянная Больцмана.
10. Средняя полная кинетическая энергия молекулы:
áЕñ =  kT,
kT,
где i – число степеней свободы молекулы.
11. Зависимость давления газа от концентрации молекул и температуры:
p = nkT.
12. Скорости молекул:
средняя квадратичная  ;
;
средняя арифметическая 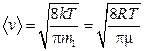 ;
;
наиболее вероятная  ,
,
где m1 – масса одной молекулы.
13. Относительная скорость молекулы:

где v – скорость данной молекулы.
14. Распределение скоростей молекул по Максвеллу:

где DN(v) – число молекул, скорости которых лежат в интервале от v до v + Dv.
15. Барометрическая формула:

или
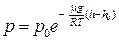 ,
,
где р и р0 – давление газа на высоте h и h0.
16. Распределение Больцмана:
 ,
,
где n0 и Е0 – концентрация и потенциальная энергия частиц на высоте h0.
17. Средняя длина свободного пробега молекул:
 ,
,
где <v> – средняя арифметическая скорость, <z> – среднее число столкновений каждой молекулы с остальными в единицу времени, s – эффективный диаметр молекулы, n – число молекул в единице объема (концентрация молекул). Общее число столкновений всех молекул в единице объема за единицу времени Z = <z> n/2.
18. Масса, перенесенная за время Dt при диффузии (закон Фика):
 ,
,
где Dr/Dх – градиент плотности в направлении, перпендикулярном к площадке DS, D = <v><l>/3 – коэффициент диффузии (<v> – средняя арифметическая скорость, <l> – средняя длина свободного пробега молекул).
19. Импульс, перенесенный газом за время Dt, определяет силу внутреннего трения Fтр в газе (закон Ньютона):
 ,
,
где Dv/Dx – градиент скорости течения газа в направлении, перпендикулярном к площадке DS, h = <v><l>r/3 – динамическая вязкость.
20. Количество теплоты, перенесенное за время Dt вследствие теплопроводности, определяется формулой (закон Фурье):
 ,
,
где DТ/Dx – градиент температуры в направлении, перпендикулярном к площадке DS, К = <v><l>сVr/3 – коэффициент теплопроводности.
Дата добавления: 2016-07-22; просмотров: 1279;











